뉴스·공시
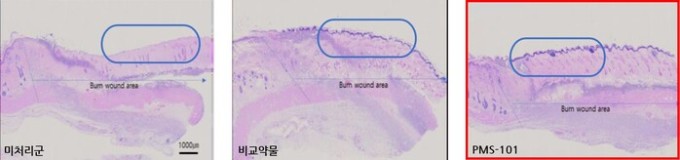 |
| PMS-101 효능 데이터 (사진=강스템바이오텍(217730) 제공) |
[서울 = 뉴스핌] 메디컬투데이 = 강스템바이오텍은 계열사 프리모리스테라퓨틱스의 엑소좀 기반 화상치료제 'PMS-101'이 호주 식품의약품안전청(이하 TGA)으로부터 1/2a상 임상시험계획(CTN)을 승인 받았다고 1일 밝혔다.
호주 CTN은 임상시험 개시를 위한 절차로 국내 임상시험계획(IND)과 동일하게 허가기관으로부터 승인 후 임상시험에 돌입할 수 있다.
PMS-101은 줄기세포 유래 엑소좀 기반 화상치료제다. 엑소좀은 조직재생 및 염증억제 효능이 뛰어나, 손상부위의 염증 반응 후 피부조직이 재생되면서 치유되는 화상 치료에 매우 효과적이다.
프리모리스테라퓨틱스는 하이드로겔 패치 제형으로 화상 부위의 조직재생을 촉진함으로써 현재 화상 표준 치료법인 드레싱 대비 피부가 재건되는(재상피화) 시간을 단축시켰다. 또한, 동물실험을 통해 PMS-101을 사용할 시 새로 성장하는 피부조직의 길이가 약물 미사용군 대비 45%, 현재 치료에 적용되는 약물 대비 23% 증가한다는 데이터를 확보했다.
더불어, 프리모리스테라퓨틱스는 높은 효능의 화상치료제 개발을 위해 기존 엑소좀보다 세포성장, 재생 및 항염 기능을 강화한 엑소좀 'ExoPlus'를 개발했으며, 강스템바이오텍의 CMO(위탁생산)를 통해 100L 스케일에 해당하는 대량생산공정을 구축하여 후기 임상 및 상업화 시 품질관리 등 엑소좀 치료제의 난관 요소인 생산 리스크를 해소했다.
프리모리스테라퓨틱스 나규흠 대표는 "호주 임상시험은 미국의 임상규격을 지켜 수행할 경우 해당 데이터를 인정받아 추후 미국, 유럽 등 글로벌 임상 진행의 토대를 마련할 수 있다. 또한, 국내 시장 점유를 위하여 향후 치료제 개발 시 국내 최대 화상 전문 병원으로의 공급도 협의돼 있다"며 "빠른 상업화를 위해 임상 진입부터 추후 임상 진행방향 및 사업전략 등을 수립한 만큼 이번 임상 1/2a상에서 PMS-101의 안전성과 탐색적 유효성을 확보할 것이다"고 말했다.
이 기사는 메디컬투데이가 제공하는 기사입니다
저작권자(c) 글로벌리더의 지름길 종합뉴스통신사 뉴스핌(Newspim), 무단 전재-재배포 금지
뉴스속보
- 강스템바이오텍 “바이오 유럽서 다국적 제약사와 기술수출 논의” 한국경제
- 파멥신, 자회사 "좋은타이어" 흡수합병 완료…신규 사업 진출 본격화 뉴스핌
- 티앤알바이오팹, Foam 제형 창상피복재 2종 식약처 허가 획득 뉴스핌
- 네이처셀, "조인트스템" 미 FDA 첨단재생의료치료제 지정 뉴스핌
- 특징주, 강스템바이오텍-제대혈 테마 상승세에 10.4% ↑ 라씨로
- '강스템바이오텍' 10% 이상 상승, 전일 외국인 대량 순매수 라씨로
- 강스템바이오텍 "GMP센터 세포처리시설 허가 취득" 뉴스핌
- 강스템바이오텍, GMP센터 첨단재생의료 세포처리시설 허가 취득 한국경제
- 강스템바이오텍, 산자부 주관 2024년 소재부품개발사업 선정 한국경제
- 지에프퍼멘텍, 상반기 영업이익 25억원…흑자전환 뉴스핌





