[의학신문·일간보사=김자연 기자] 지난해 미국에서 48개 신규활성물질(NAS) 의약품이 출시된 가운데 85%가 신흥 생명공·제약(EBP) 기업으로부터 나왔다고 아이큐비아는 밝혔다.
이에 따르면 연간 연구개발 지출 2억달러 미만 또는 매출 5억달러 이하인 EBP가 작년 출시 NAS 중 63%의 승인신청까지 직접 담당한 것으로 집계됐다.
아울러 작년 미국서 나온 NAS는 특허 출원으로부터 출시되기까지 걸린 개발 타임라인이 중간 14.4년으로 전년도의 13.4년에 비해 길어졌다.
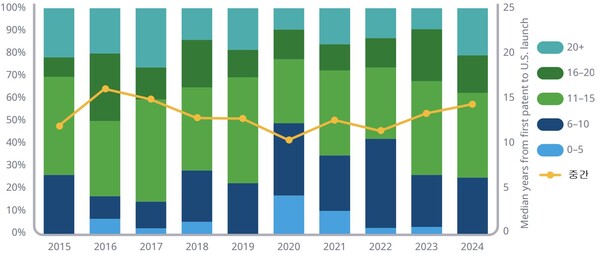
작년에 나온 NAS 중 3/4 이상은 특허 신청에서 출시에 이르기까지 10년 이상이 걸린 가운데 가장 많은 경우 11~15년이 소요된 것으로 파악됐다.
또한 작년 미국 출시 NAS 중 79%는 우선심사, 신속승인, 혁신약 지정, 가속 승인 등 적어도 하나 이상의 단축 통로를 거쳤으며 이 경우 개발 타임라인이 평균 3.5년 더 단축되는 것으로 추산됐다.
즉, 작년 미국서 나온 NAS 중 60%는 우선심사, 44%가 혁신약 지정, 46%가 신속심사 통로, 21%가 가속 승인으로 허가됐다.
더불어 작년 미국 출시 NAS 중 70% 이상이 승인 적응증 가운데 하나 이상의 희귀약 지정을 보유해 비희귀 치료제에 비해서는 개발 타임라인이 1.9년 짧았다.
또 작년 미국 출시 NAS 중 93%가 특수약으로 분류된 가운데 60% 가까이가 신계열이었고 그 중 10개는 항암제로 특히 이중특이 항체가 3개, 세포 치료제 2개가 속했다.
특수약은 지난 6년 동안 기존 전통적 치료제에 비해 개발 타임라인이 중간 2.9년 더 빨랐는데 이들은 미충족 수요가 높은 분야에서 신속 심사를 받는 경우가 많기 때문이다.
반면 신계열 NAS는 다른 치료제에 비해 시장 출시가 평균적으로 약 1년은 더딘 것으로 나타났는데 새로운 분야에 과학적 이해 확장을 위해 시간이 더 걸리기 때문인 것으로 설명됐다.
그리고 작년 미국 출시 NAS 중 절반이 생물약이었으며 개발 타임라인은 저분자에 비해 2년더 빠른 것으로 파악됐다.
이는 생물약이 종종 미충족 수요가 높은 질환을 노려 각종 신속 심사를 받거나 일부는 바이오마커가 있기 때문인 것으로 해석됐다.
이에 비해 작년 미국 출시 NAS 중 허가 시 예측적 바이오마커 기준이나 동반 진단이 있는 경우는 20% 미만이었다.
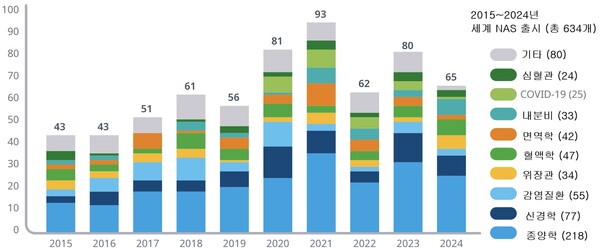
질환별로는 작년 미국 출시 NAS 중 종양학 의약품이 16개로 가장 많았고 신경학에 8개, 혈액학에 6개로 이어졌다.
이와 관련, 지난 10년 동안 특허출원 10년 이내에 출시된 NAS 중 42%가 종양학 분야로 가장 많았고 이어 16%는 신경학 부문으로 파악됐다.
한편, 세계적으로는 작년 65개의 NAS가 출시돼 전년도에 비해 19% 줄었지만 팬데믹 이전에 비해서는 높은 수준이었다.










댓글목록