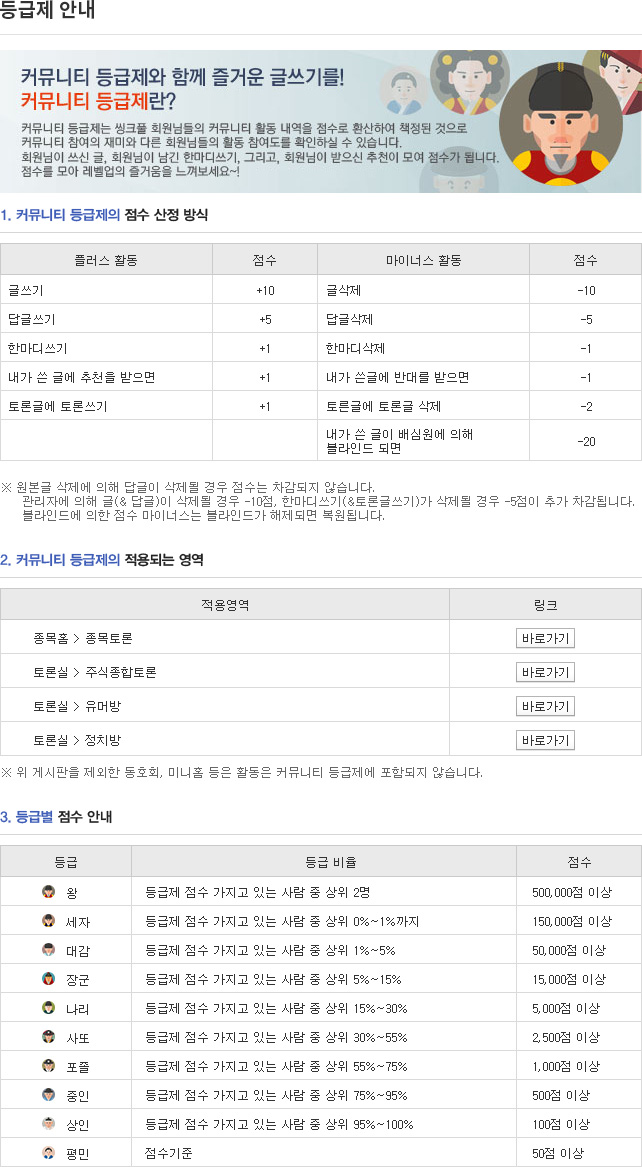
종목토론카테고리
게시판버튼
게시글 제목
대만 암성통증 업데이트 12,29일자게시글 내용
| 試驗申請者: | 精睿醫藥科技股份有限公司 |
|---|---|
| 試驗委託/贊助單位名稱: | Komipharm International Australia Pty Ltd. |
| 試驗計畫書編號: | KOM-PAX1-001 |
| 核准執行文號: | 1096031944 |
| 核准登錄日期: | 2020-12-09 |
| 試驗預計執行期間: | 2021-01-01 至 2022-03-31 |
![]() 試驗目的
試驗目的
主要目的:
本試驗的主要目的為根據每日疼痛平均值降低30% (含)以上的患者人數來評估每天服用7.5 mg PAX-1在治療持續性癌症疼痛之輔助性止痛的功效。疼痛指數將由共11個等級(0到10)的數字評估量表 (Numerical rating scale, NRS) 來評估。
次要目的:
評估每天服用7.5 mg PAX-1在減少對鴉片類藥物的需求並輔助治療持續性癌症疼痛的臨床益處,評估方法如下:
1.減少病人鴉片類藥物的使用量(包含治療背景和/或突發性疼痛(救援)之藥物)。以換算成嗎啡當量 (morphine-equivalents) 後的總和作為評估標準
2.NRS疼痛指數平均值的變化
3.突發性疼痛的頻率
4.功能狀況:美國東岸癌症臨床研究合作組織(ECOG)體能狀況量表
5.病人報告效果 (Patient reported outcome):簡明疼痛調查表(Short Form Brief Pain Inventory)
6.病患整體改善量表(Patient Global Impression of Change, PGIC)
7.評估PAX-1使用在患有持續症疼痛之藥效學
![]() 試驗階段分級
試驗階段分級
Phase Ⅱ
![]() 藥品名稱
藥品名稱
PAX-1
![]() 主成分,劑型,劑量
主成分,劑型,劑量
持續性癌症疼痛
![]() 試驗醫院 / 受試者 召募狀態
試驗醫院 / 受試者 召募狀態
| 試驗醫院 | 受試者召募狀態 | |
|---|---|---|
| 長庚醫療財團法人基隆長庚紀念醫院及其情人湖院區 | 2021-06-25 | 召募中 |
| 長庚醫療財團法人嘉義長庚紀念醫院 | N/A | N/A |
| 財團法人奇美醫院 | N/A | N/A |
| 財團法人彰化基督教醫院 | 2021-06-21 | 召募中 |
| 臺中榮民總醫院 | N/A | N/A |
| 衛生福利部雙和醫院 | 2021-05-05 | 召募中 |
![]() 評估指標(endpoint)
評估指標(endpoint)
主要評估指標
以共11個等級(0到10)的數字評估量表 (Numerical Rating Scale, NRS) 所記錄的每日疼痛指數為依據,在為期4週之雙盲治療期 1結束時的每日疼痛指數之平均值相較於在篩選期間連續7天所記錄的基線值降低大於或等於30% 的患者人數。每日疼痛指數之平均值是指患者在日誌中所記錄,回診訪視前7天的每日整體疼痛指數之平均值。
次要評估指標
1. 使用PAX-1的患者中,在為期4週之雙盲治療期(治療期1)結束時鴉片類藥物的使用量與篩選期連續7天所記錄的基線值相比減少了大於或等於 25% 的人數。鴉片類藥物的使用量(包含治療背景和/或突發性疼痛(救援)之藥物)為換算成嗎啡當量後的總和。
2. 治療期1間,NRS疼痛指數平均值相對於基線值(篩選期的記錄)的變化。
3. 與篩選期間連續7天所記錄的基線值相比,突破性疼痛發生的頻率(在治療期1的第4週中,患者經歷突破性疼痛的天數和每天的次數)。
5. 功能狀況(ECOG體能狀況量表)。
6. 病人報告結果(BPI-SF)。
7. 和篩選期的基線值相比,在4週的治療期(治療期1)間,患者的整體改善量表(PGIC)。
8. 依據血液中CRP,IL-1 beta、IL-6、IL-8和TNF-alpha 的量評估PAX-1的藥效學活性。
![]() 主要納入/排除條件
主要納入/排除條件
納入條件:
1. 您年滿20歲。
2. 您患有晚期實體腫瘤 (即不太可能藉由治療而被治癒或控制的腫瘤) 且您的預估存活期大於或等於3個月。如您患有晚期多發性骨髓瘤或淋巴瘤,也符合此條件。
3. 您患有持續性癌症疼痛,且在篩選期間至少連續7天接受穩定的鴉片類藥物治療。持續性癌症疼痛指由原發癌或轉移後所造成的疼痛(即慢性癌症疼痛)或癌症治療所引起的疼痛(即慢性治療後疼痛)。
4. 在篩選期間會請您使用數字評估量表 (NRS) 連續7天記錄您每天所經歷的疼痛強度。在這7天中至少有2天,您的疼痛強度大於或等於4(疼痛強度等級從0到10, 最痛的等級為10)。
5. 如果您目前正在接受輔助性止痛藥物治療,則在篩選期前給藥劑量必須維持固定至少達7天。
6. 如果您目前正在接受癌症治療(荷爾蒙治療,生物製劑治療,化學治療,標靶治療或放射線治療),則在篩選期前癌症治療劑量維持固定至少達2週。
7. 您的ECOG體能狀況評估為0到3級。
8. 您必須能夠了解試驗的性質並有簽署書面同意書的能力。您也需願意定期回診,填寫試驗問卷和日誌,並告知試驗人員所發生的不良事件和併用藥物。
9. 您必須具有適當的血液,肝和腎功能,並符合以下檢驗數據結果:
a. 絕對嗜中性白血球計數(absolute neutrophil count, ANC)> 1.5 x10^9/升 (L)
b. 血小板計數 > 100 x10^9/升 (L)
c. 血紅素 > 90 克/升 (L)(即 > 9.0克/分升 (dL))
d. 總膽紅素 < 正常值上限 (ULN) 的1.5倍(如果患者患有吉伯特氏症候群,則< 2.5 x ULN)
e. AST/ALT小於或等於 2.5 x ULN;肝轉移或肝癌患者小於或等於5 x ULN
f. 血清肌酸酐在正常值內或計算得出的肌酸酐清除率 > 50 毫升/分鐘 (mL/min)
g. 血清中鉀和鎂的濃度在正常值內(如果濃度過低,可以使用鉀和鎂補充療法)
h. 血清中電解質濃度(包括鈉,鈣,磷和氯)在正常值內或試驗醫師認為數值無臨床上顯著意義
血清電解質濃度(包含以上(g)和(h)中所列出的電解質)不在正常值內的患者可在篩選期間重新檢測一次。
10. 您必須能夠服用口服藥。
11. 如果您是女性,則必須是:
a. 不具生育能力、停經。且在篩選期時血清中濾泡成熟激素(FSH)的含量需大於 40 mIU/mL (70歲(含)以上的患者不需接受此檢驗),或臨床上判斷為不育(例如子宮已經被移除)
b. 若具生育能力,則在開始服用試驗藥物前,懷孕測試的結果須為陰性,以排除懷孕的可能。
12. 如果您是男性或具有生育能力的女性,則必須同意從篩選期開始到試驗最後一次訪視後的90天內不懷孕,並使用有效的避孕方法。試驗醫師會和您討論有效的避孕方法。
13. 您必須同意在參加此臨床試驗的同時不再參與其他臨床試驗。
排除條件:
1. 經試驗醫師評估,您患有可能影響試驗藥物吸收的腸胃道疾病(例如:臨床明顯異常之慢性腹瀉或嘔吐、 吸收不良症候群或小腸切除)。
2. 您患有人類免疫缺乏病毒 (HIV) 感染,後天免疫缺乏症候群 (AIDS),自體免疫性疾病(包括克隆氏症和發炎性腸道疾病)的病史或因為器官移植而需要使用免疫抑制劑。
3. 您在試驗過程中接受非預期的用來緩解癌症疼痛目的的緩和性放射治療。
4. 您預計在試驗期間接受重大手術。
5. 您正在哺育母乳。
6. 心電圖顯示您的QTcF間距大於450毫秒(若您為男性)或470毫秒(若您為女性)或您患有特定種類的心律不整(例如:心跳過慢、心室性頻脈等)、或是您正在服用或預計要服用可能會影響QTc的藥物。
7. 您有下列的狀況:無法控制的心臟疾病(例如,無法控制的高血壓(舒張壓大於100,或收縮壓大於180)),嚴重且不穩定的心絞痛,在篩選期的前12個月內發生過心肌梗塞。
8. 您患有中度至重度的心臟衰竭 (即紐約心臟協會功能性分級第III或第IV級)。
9. 您對偏亞砷酸鈉,相關化合物或試驗藥物的任何賦形劑過敏。
10. 在篩選期前的4週內,您曾接受過其他試驗性治療。
11. 您尚未從過去治療所造成的毒性反應中恢復,即您毒性反應的嚴重程度仍然大於或等於CTCAE第2級(但血紅蛋白,脫髮,色素沉殿和因化療引起的神經毒性則不在此限)。
12. 試驗醫師認為您不適合參加本試驗。
![]() 試驗計畫聯絡資訊
試驗計畫聯絡資訊
精睿醫藥科技股份有限公司
02-2789-1060#320
潘小姐
本計畫預計收納受試者人數:台灣人數 64 人,全球人數 64 人
PAX-1 쌍지속적인 암통증의 진통효과의 탐색성, 무작위 그룹, 쌍맹이, 평행, 위로제와 대조하는 IIa기 임상시험
시험 신청자:
정예의약과기주식유한회사
시험의뢰/후원서비트 이름:
Komipharm International Australia Pty Ltd.
시험 계획서 번호:
KOM-PAX1-001
실행 문호 확인:
1096031944
로그인 날짜 확인:
2020-12-09
시험예상실행기간:
2021-01-01-2022-03-31
시험 목적
주요 목적:
본 시험의 주요 목적일일통증평균치 30% 이상(포함) 환자 수 평가 위해 7.5mg PAX-1 복용시 지속성 암통 치료통증의 보조적 진통의 공효과. 통증지수 총 11등급에서(0부터 10까지)의 디지털 평가량표 (Numerical rating scale, NRS)로 평가합니다.
부차적 목적:
매일 7.5mg PAX-1은 아편류에 대한 수요를 감소시키고 지속적인 암통증의 임상적 이점을 보조하며, 평가방법은 다음과 같다.
1. 환자의 아편을 줄인다류의 사용량(치료 배경과/또는 돌발적인 통증(구급)을 포함)엔도르핀 당량으로 환산 (morphine-equi)valents) 후의 총합은 평가기준으로 한다
2.NRS 통증손가락평균의 변화를 세다
3.돌발적으로 아픈주파수
4.기능상황:미국립동안암임상연구협력기구(ECOG) 체력량표
5. 환자 보고 효과 (Patient reported outcome) : 간단한 통증 조사표(Short Form Brief P)ain Inven토리)
6. 전반적인 질병 개선계량기(Patient Global Impression of Change,PGIC)
7. PAX 평가 -1 지속증 통증이 있는 약효학에 사용
시험 단계 단계별
Phase Ⅱ
약품명
PAX-1
주성분, 제형, 제제재다
sodium m이타 아르세나이트정제 2.5mg
공명적응증
지속성 암 통증
시험병원/수용시자소집 상태
시험 병원
피험자 모집 상태
장경의료재단법인기륭장경기념병원과 그의 연인 호원구 2021-06-25소모중
장경의료재단법인자이장경기념병원 N/AN/A
재단법인 기미병원 N/AN/A
재단법인창화그리스도교의원 2021-06-21소모중
타이중영민총병원 N/AN/A
위생 복지부 양허의정원 2021-05145 모집 중
평가지표(end)포인트)
주요 평가지표
총 11등급으로(0에서 10)까지의 숫자 평가량표(Numerical Rating Scale, NRS)에 기록된 일일 통증 지수는근거, 4주 동안양맹치료기 1종료시 매일통증통증 지수의 평균은 선별기와 비교된다7일 연속 기록된 기준치도 30% 이상 낮췄거나 같다.일일 통증 지수의 평균은 환자가 있는 것을 가리킨다일지에 기록된 것, 회진 취재7일 전 일일 전체 통증 수치 상평균값.
부차적 평가지표
1.PAX 사용-1의 환자 중 4주간의 쌍맹치료기(치료기1) 종료시 아편류 사용량은 선별기간 7일 연속 기록된 기준치 대비 감소적게는 2보다 많거나 같다사람의 수의 5%. 아편류의 작용사용량(치료 배경과/돌발 포함)성통증(구급)은 엔도르핀 당량으로 환산한 것이다.
2. 치료기 1칸NRS 통증지수 평균은 기준치(선별기 기록)에 비해 달라집니다.
3. 및 선별기간7일 연속 기록된 기준치 대비 파격적인 통증 발생 빈도(치료기 1의 4주차에서 환자가 획기적인 통증을 경험한 일수와 하루 횟수))。
5.기능상황(ECOG 체력량표).
6.환자 보고 매듭과(BPI-SF).
7. 선별기의기준치 대비 4주간의 치료기(치료기1)간 환자의 전반적인 개선량표(PGIC)입니다.
8. 혈액 속에CRP, IL-1 beta, IL-6, IL-8 및 TNF-alpha의 양으로 PAX-1의 약효학적 활성을 평가합니다.
주요 포함/배제 항목건
조건 포함:
1.당신은 만 20세입니다해.
2. 말기를 앓고 계십니다실체 종양(즉, 치료에 의존하여 치유되거나 제어될 가능성이 크지 않은 종양)은 당신의 예상 당좌 기간이 3개월보다 크거나 같습니다.말기 다발성골을 앓고 계시면골수종 혹은 림프종도 적합하다.이 조건에 부합하다.
3. 지속가능성 질환성암 통증은 물론 선별 기간에도 최소 7일간 안정적인 아편류 약물치료를 받는다.지속성 암통증이란 원발암 또는 전이후로 인한 통증(만성암통증) 또는암 치료로 인한 통증치료 후 통증).
4. 선별기간 동안일일 통증 강도를 디지털 평가표( NRS)로 7일 연속 기록하십시오.7일 중 적어도 2일은 통증의 강도가 높습니다또는 4와 같다(통증이 강하다)0부터 10까지 가장 아픈 등급은 10).
5. 만약 당신이 현재보조성 진통제 치료를 받고 있는 경우 선별기간 전 최소 7일간 일정하게 약을 공급해야 한다.
6. 만약 당신이 현재암치료(호르몬치료, 바이오시밀러치료, 화학치료, 표적치료 또는 방사선치료)를 받고 있다면 선별기간까지 암치료제 투여량이 고착화됨최소 2주에 달할 것으로 보인다.
7. 당신의 에코G체력은 0~3등급으로 평가됐다.
8.당신은 할 수 있어야 한다시험의 성격을 이해하고 서면 동의서에 서명할 능력이 있다.당신도 정기적으로 회진하여, 시험 설문지와 일지를 작성하고, 시험 인원에게 발생한 불량한 일을 알려주기를 원합니다문서와 병용 약.
9.당신은 가져야 한다적절한 혈액, 간 및 신장 기능은 다음과 같은 검사 데이터에 부합합니다.
a. 절대적인 중립성백혈구 계수 (absolute neutrophil count, ANC) > 1.5 x10^9(l)
b. 혈소판 계수 > 100 x10^9(l)
c. 헤모글로빈 > 90그램/리터(L)(즉 >9.0그램/리터(dL))
d. 빌리루빈 <정상치 상한선(ULN)의 1.5배 (환자가 길버트 증후군을 앓고 있다면 <2.5 x ULN)
e. AST/ALT가 2.5 x ULN보다 작거나, 간 전이 또는 간암 환자가 5 x ULN보다 작거나 같습니다
f. 혈청근산가스정상값 또는 계산된 근산가스 제거율 > 50ml/분 (mL/min)
g. 혈청에는 칼륨과마그네슘 농도는 정상치 이내(농도가 너무 낮으면 칼륨 및 마그네슘 보충요법 사용)
h.혈청중전해질량 농도(나트륨,칼슘,인 및 염소 포함)는 정상치 이내 또는 시험의사가 수치에 임상적으로 현저한 의의가 없다고 판단함
혈청전해질 농도(이상(g)과 (h)에 나와 있는 전해질을 포함하면 정상치 안에 없는 환자는 선별 기간에 한 번 다시 검사할 수 있다.
10.당신은 할 수 있어야 합니다경구약을 충분히 복용하다.
11.당신이 맞다면여성은 다음과 같이 해야 한다.
a. 출산능력이 없다힘, 정경. 또한 선별기 때 혈청에 40mIU/mL(70세 포함) 이상 여과성숙호르몬(FSH) 함량이어야 하는 환자이 검사를 받지 않아도 된다),혹은 임상적으로 불임으로 판단됩니다(예를 들어 자궁삭제됨)
b. 출산능력이 있다면힘의 경우, 시험 약물을 복용하기 전에 임신 테스트 결과가 음성으로 나와 임신 가능성을 배제해야 한다.
12.당신이 맞다면남성이나 출산능력이 있는 여성은 선별기간부터 마지막 방문까지 90일 동안 임신을 하지 않고 효과적인 피임법을 사용하는 것에 동의해야 한다.의사 선생님과 토론하기효과적인 피임 방법.
13. 당신은 같아야 합니다.이 임상시험에 참가함과 동시에 다른 임상시험에는 참여하지 않겠다는 의지다.
제외 조건:
1.시험의사평가, 당신은 실험약물의 흡수에 영향을 줄 수 있는 위장질환(예: 임상적으로 뚜렷한 이상 만성 설사나 구토, 흡수불량 증후군 또는 소장절제)을 앓고 있습니다.)。
2. 당신은 인간을 앓고 있다면역결핍바이러스(HIV) 감염, 후천성면역결핍증후군(AIDS), 자가면역질환(클론병과 발염성 장질환 포함)병)의 병력 혹은 원인관이식을 위해서는 면역억제제를 사용해야 한다.
3. 시험 중이신 경우암의 통증을 완화하는 목적으로 의도하지 않은 완화적 방사선 치료를 받는 것이다.
4.당신은 시도할 예정입니다.검진 기간에 중대한 수술을 받다.
5. 당신은 지금 키우고 있습니다.모유.
6. 심전도 표시QTCF가 450밀리초 이상 떨어져 있거나(예: 심장 박동) 470밀리초 이상 떨어져 있거나(예: 심장 박동) 특정한 종류의 부정맥이 있습니다(예:느림, 심실성 빈맥 등) 또는 복용 중이거나 복용 예정입니다.QTc에 영향을 줄 수 있는 약물을 사용하십시오.
7.당신은 다음과 같은 것이 있습니다.상황: 제어할 수 없는 심장질환(예를 들어 제어할 수 없는 고혈압(서장압 100 이상 또는 수축압 180 이상), 심각하고 불안정한 심쥐어짜는 통증, 선별기 전에12개월 내에 심근경색이 발생한 적이 있다.
8. 중도를 앓고 계십니다극도의 심장부전증(즉 뉴욕심장협회 기능성 등급 제III 또는 제IV급)입니다.
9. 편아비소에 대하여산나트륨, 관련 화합물이나 실험약물의 어떤 부형제도 알레르기입니다.
10.선별기에이전 4주 동안 다른 시험치료를 받으셨습니다.
11.당신은 아직 시작하지 않았습니다.과거 치료로 인한 독성 반응의 회복 즉, 당신의 독성 반응의 심각도는 CTCAE 제2급보다 크거나 같습니다(단, 헤모글로빈, 탈모, 색소)침전과 화학요법으로 인한신경독성은 이에 해당하지 않는다).
12.시험의사당신이 이 시험에 참가하기에 적합하지 않다고 생각합니다.
시험 계획 연락 정보
정예의약과기주분유한정회사
02-2789-1060#320
미스 반
시험계획수험자인원을 받아들이다
본 계획 수납 예상응시자 수: 대만인 64명, 전 세계 64명
본 계획 자료는 최근 갱신되었다새 날짜: 2021-12-29
게시글 찬성/반대
- 6추천
- 0반대
운영배심원의견
운영배심원의견이란
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.






댓글목록