정부가 첨단재생의료와 첨단바이오의약품 2022년 주요정책 시행에 대해 심의한 가운데, 첨단재생의료에서의 ‘고위험 임상연구 심의·승인’ 절차 이중규제가 해소돼 주목된다.

정부는 김강립 식품의약품안전처(이하 ’식약처‘) 처장의 주재로 30일 오전 프레지던트호텔(서울 중구 소재)에서 ‘제4차 첨단재생의료 및 첨단바이오의약품 정책심의위원회(이하 ’정책심의위원회‘)’를 개최했다.
4차 정책심의위원회에서는 ‘2021년 첨단재생의료 정책 추진 현황’을 보고 받고, ‘고위험 임상연구 심의‧승인 절차 개선 방안’과 관계부처 합동으로 마련된 ‘2022년 첨단재생의료 및 첨단바이오의약품 시행계획’을 심의했다.
그동안 추진된 경과는 △첨단재생의료 인프라 조성 △첨단재생의료 임상연구 활성화 △첨단재생의료 R&D 예산 지원 등 3가지 주요한 분야에서의 추진 현황과 계획 등이다.
◆첨단재생의료 인프라 조성= 우선 첨단재생의료분야의 기본적인 체계를 조성하기 위해 ‘제1차 첨단재생의료‧첨단바이오의약품 5개년 기본계획(2021~2025)’을 마련(2021년 1월)했다.
첨단재생의료 연구에 대한 국가 차원의 통합 심의체계 구축, 첨단재생의료실시기관 지정, 임상연구에 대한 R&D 예산 지원, 재생의료분야 전주기 기술개발 지원 등이 주요 과제로 담겼다. 임상연구를 실시할 수 있는 첨단재생의료실시기관이 총 34개 지정됐다.
올해 1월 실시기관이 갖추어야 할 시설‧장비, 인력, 작업지침서 등의 지정기준을 마련한 이후, 2차례에 걸쳐 실시기관 공모 및 지정 절차를 진행했고, 세 번째 공모를 연말까지 진행 중이다.
첨단재생의료 실시기관 임상연구인력의 필수 기본 교육을 마련해 운영(4월~)하고 있으며, 임상연구인력, 세포처리시설 종사자 등 실시기관의 필수인력 총 787명이 교육을 수료했다.
◆첨단재생의료 임상연구 활성화= 첨단재생의료실시기관에서 제출한 임상연구 계획 중 적합 의결을 받은 계획은 총 6건이며, 이 중 고위험*이 4건, 중위험이 2건이다.
고위험 임상연구계획 중 1건이 식약처의 최종 승인(2021년 12월 8일)을 받았으며, 그 외 3건은 현재 검토 중에 있다. 식약처의 최종 승인을 받은 1호 연구는 CAR-T를 사용해 소아청소년 급성림프모구백혈병 환자의 치료를 목적으로 하는 것으로, 기존의 항암화학요법과 달리 암세포만을 정확히 표적하면서도 체내 정상세포 손상을 최소화할 것으로 기대된다.
‘첨단재생의료 및 첨단바이오의약품 심의위원회(이하 ’심의위원회‘)’로 상정된 임상연구계획은 세포치료제가 대부분으로, 향후 유전자치료, 조직공학치료 등에 대한 임상연구의 활성화에 노력할 계획이다.
◆첨단재생의료 R&D 예산 지원= 재생의료기술의 원천연구-연계연구-임상연구-임상시험-치료제 개발까지 전 주기에 걸친 R&D 지원을 실시했다.
올해는 원천기술 16개, 연계기술 31개, 치료제‧치료기술 4개 등 총 51개 과제에 대해 지원 중이며, 고위험 1호로 승인받은 임상연구계획 등에 대한 임상연구비도 지원할 예정이다. (최대 연 10억 이내 및 최대 3년 지원)
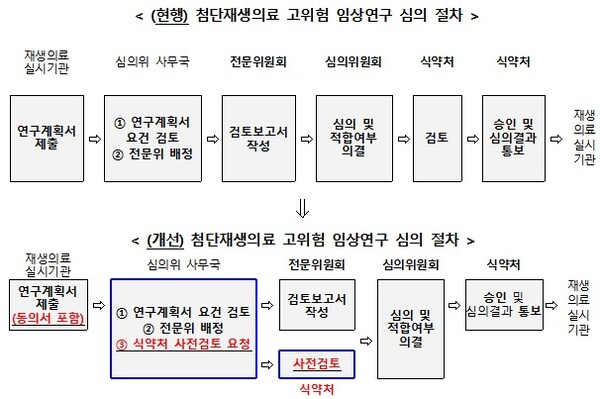
‘고위험 임상연구 심의‧승인 절차 개선 방안’은 기존의 고위험 임상연구 심의‧승인 절차의 이중 규제를 해소하기 위해 마련했다.
기존 고위험 임상연구계획은 임상연구를 실시하기 위해 전문위원회의 검토 결과를 토대로 심의위원회에서 심의를 진행하고, 적합 의결 이후 식약처의 승인 절차가 진행됨에 따라, 심의위원회의 의결 이후 식약처에서 연구자에게 보완 자료 제출 요청 등 추가 심사가 이뤄져, 최종 승인까지의 소요 기간이 장기화되고 연구 개시가 지연되는 등 문제가 발생했다.







댓글목록