미국에서 최근 델타 변이로 인해 바이든 대통령이 규제 당국의 결정도 추월하며 일반 인구에 대한 코로나19 백신 추가 접종 계획을 밝힌 가운데, FDA 및 WHO의 세계적인 과학자들은 아직 근거가 없다며 란셋을 통해 반대 의사를 밝혔다.
최근 바이든의 추가접종 계획 발표 직후 사임 의사를 밝힌 FDA 필 크라우제 부국장과 메리언 그루버 백신 연구·심사 국장 및 WHO의 최고위급 과학 관리들로 이뤄진 저자들은 다양한 실세계 관찰 연구 및 백신의 승인 전 임상시험 데이터를 검토한 결과 이같이 발표했다.
이에 따르면 비록 승인된 백신이 증상적 감염 예방 효과는 떨어졌어도 여전히 중증 감염을 낮출 수 있는 효과는 높은 가운데 현재의 근거는 일반 인구에 대한 추가 접종의 필요성을 보이지 못하고 있다.
또한 지금까지 특정 변이에 대한 백신의 효과나 지속 기간에 대한 평가는 거의 관찰 연구에 근거를 뒀는데 그 결론은 아직 예비적이며 해석하기도 어렵다.
특히 mRNA 백신의 경우 드물지만 심근염 등 부작용 연관성이 있는 등 불필요하게 추가 접종을 너무 빨리 혹은 자주 하면 상당한 위험을 일으킬 수 있다고 그들은 지적했다.
또한 중증 질환에 대한 보호는 단기적인 항체 반응 뿐만이 아니라 기억 반응 및 세포-매개 면역 등으로 인해 중개되며, 추가 접종의 필요성이나 시기는 적절한 대조 임상 및 역학 데이터를 주의 깊게 분석하고 적절한 근거가 분명할 때에만 진행돼야 한다는 지적이다.
따라서 추가 접종을 합리화하기 위해선 더욱 근거가 필요하며 백신의 위험 대비 효과 평가는 예방 가능한 중증 코로나19 케이스의 수 및 현재 변이에 대한 안전성과 효과 등을 고려해야 된다. 단, 면역이 약화된 사람 등 일부는 추가 접종으로 효과를 볼 수도 있다고 저자들은 덧붙였다.
스웨덴 진단기업과 계약 체결
췌장암 키트도 개발나서
[ 오상헌 기자 ] 췌장암은 ‘최악의 암’으로 불린다. 5년 생존율(12%)이 주요 암 중에서 가장 낮기 때문이다. 췌장암이 무서운 건 악성도가 높아서가 아니라 암이 온몸에 퍼질 때까지 별다른 증상이 없다는 데 있다. 이상을 느꼈을 땐 더 이상 손쓸 수 없을 정도가 된 경우가 대부분이다.
JW생명과학의 자회사인 JW바이오사이언스는 여기에 주목했다. 췌장암을 조기에 진단할 수 있는 바이오마커(생체표지자)만 찾아내면 최악의 암을 극복할 길이 열릴 것으로 본 것.
JW바이오사이언스는 그렇게 3년 동안 파고들어 찾아낸 바이오마커를 14일 스웨덴 진단기업 이뮤노비아에 기술수출했다. 국내 기업이 바이오마커를 기술이전한 건 이번이 처음이다.
JW가 발굴한 바이오마커는 CFB다. 췌장암 초기 환자를 찾아낼 수 있는 마커다. 여기에 기존 췌장암 말기환자 진단에 써온 CA19-9를 더해 정확도를 높였다. 신촌 세브란스병원과 함께 500여 명을 대상으로 임상시험한 결과 췌장암 진단 정확도가 90%를 넘었다고 회사 측은 설명했다. 다른 암과 췌장암을 구분하는 특이도는 98%에 달했다.
이뮤노비아는 이번 계약을 통해 JW의 원천기술을 활용해 췌장암 진단키트 등을 개발할 수 있게 됐다. 다만 독점사용 계약이 아닌 만큼 JW는 다른 업체에도 원천기술을 추가로 팔 수 있다. JW는 한국, 미국, 유럽 21개국, 중국, 일본에서 해당 특허를 등록했다.
JW바이오사이언스도 자체 기술을 활용한 췌장암 조기 진단키트 개발에 박차를 가하고 있다. 내년에 품목허가를 받는 게 목표다. 이렇게 되면 극소량의 혈액검사로 췌장암을 조기 발견할 수 있는 길이 열린다. 초기 췌장암은 수술로 완치할 수 있는 만큼 향후 췌장암 5년 생존율이 큰 폭으로 상승할 것으로 회사 측은 기대하고 있다. 함은경 JW바이오사이언스 대표(사진)는 “JW의 기술력이 글로벌 무대에서 인정받은 셈”이라고 말했다.
JW그룹은 글로벌 체외진단 시장을 뚫기 위해 2016년 JW바이오사이언스를 설립했다. 시장조사기관 마켓앤마켓에 따르면 전 세계 체외진단시장은 2018년 약 681억달러에서 2023년 879억달러로 가파르게 성장할 것으로 예상되고 있다
파비피라비르(아비간), 코로나19치료 하이드록시클로로퀸보다 더 안전"...연구논문 디알젬의 2대주주인 후지필름그룹이 코로나19치료제로 개발중인 파비피라비르, 하이드록시클로로퀸과의 비교연구 결과
디알젬(263690)의 2대주주이자 일본의 후지필름그룹이 코로나19 치료제로 개발중인 파비피라비르(제품명 아비간)가 말라리아치료제인 하이드록시클로로퀸보다 더 안전하다는 연구결과가 나와 주목을 받고 있다.
킹 파이잘 메디컬 콤플렉스 연구진들이 지난해 6월부터 8월사이 코로나환자를 대상으로 실시한 파비피라비르와 하이드록시클로로퀸과의 비교연구에서 사망률및 산소요구도에선 비슷한 효능을 보였으며 안전성에선 파비피라비르가 더 안전한 것으로 나타났다.
이같은 연구결과는 과학 및 의학연구지인 ‘인터내셔널저널 오브 제네널메더슨’지의 9월14일 발행된 볼륨14호 (5597-5606페이지)에 실렸다.
특히 심장독성에서 파비피라비르가 하이드록시클로로퀸보다는 더 안전하다는 결론을 지었다. (FPV likely has a more favorable safety profile regarding cardiac toxicity)
이번 조사는 508명의 환자를 대상으로 진행됐으며 244명은 파비피라비르를 투여받았고 193명은 하이드록시클로로퀸을 투여받았다,
아비간은 독감치료제로 사용돼왔으며 후지필름그룹이 코로나19 치료제로 개발하고 있는 중이다. 후지필름은 코스닥 상장사인 디알젬의 주식 1백61만3800주를 보유중이다.
WCLC 2021] 티쎈트릭 단독요법 실패한 폐암 환자, 아바스틴 병용 효과
비소세포폐암 환자가 티쎈트릭(성분명 아테졸리주맙, 로슈)으로 2차 치료에 실패한 경우, 아바스틴(성분명 베바시주맙, 로슈)을 통해 다시 한 번 기회를 얻을 수 있을 것으로 보인다.
이 가운데 삼성서울병원 이지연 교수는 14일(한국시간), 세계폐암학화 국제학술회의(WCLC 2021)에서 레이블 공개 임상 2상인 ML40234 연구 결과를 공개했다.
이 연구는 이전 치료 경험이 있는 국소 진행 또는 전이성 비소세포폐암 42명에게 티쎈트릭을 투약한 후 안전성과 유효성을 평가하고, 질병이 진행한 24명을 대상으로 다시 티쎈트릭과 아바스틴 병용요법으로 후속 치료를 진행, 안전성과 유효성을 다시 평가하는 2단계로 진행됐다.
연구 대상 환자들은 EGFR 변이 야생형(Wild Type) 또는 ALK 변이 음성인 환자들로, 이전에 1차례 이상 백금기반 항암화학요법을 받은 20세 이상, 전신수행능력 평가점수(ECOG PS)는 0 또는 1이었으며, 70% 이상(73.2%)의 환자가 PD-L1 음성이었다.
▲ 삼성서울병원 이지연 교수는 14일(한국시간), 세계폐암학화 국제학술회의(WCLC 2021)에서 레이블 공개 임상 2상인 ML40234 연구 결과를 공개했다.
환자들은 1단계에서 3주 간격으로 티쎈트릭 1200mg을 투약했으며, 질병이 진행한 24명의 환자들은 후속 치료로 티센트릭 1200mg과 kg당 15mg의 아바스틴 3주 간격으로 투약했다.
아바스틴은 혈관내비성장인자(Vascular Endothelial Growth Factors, VEGF) 억제제로, 면역반응을 자극, 면역항암요법의 효과를 증진시키는 효과가 있는 것으로 알려져 있다.
연구 결과, 1단계인 티쎈트릭 단독요법에서 42명의 환자 중 1명(2.4%)만 부분 반응(Partial Respons, PR)을 보였고, 14명(35.7%)은 안전 병변(Stable Disease, SD)으로, 이에 따라 객관적 반응률(Objective Response Rate, ORR)은 2.4%, 질병조절률(Disease Control Rate, DCR)은 38.1%로 집계됐다.
반면, 24명(57.2%)는 질병이 진행(Progressive Disease, PD)됐으며, 3명(7.1%)은 평가가 불가능했다.
중앙 투약 주기는 2주기로, 반응지속기간(Duration of Rsponse, DoR)은 중앙값에 도달하지 않았으며, 치료 지속기간(Duration of Treatment, DoT) 중앙값은 0.7개월이었다.
또한, 무진행 생존기간(Progression-Free Survival, PFS) 중앙값은 1.4개월, 전체 생존기간(Overall Survival, OS) 중앙값은 12.9개월로 집계됐다.
질병이 진행돼 티쎈트릭과 아바스틴 병용요법을 투약한 24명의 환자에서는 3명(12.5%)에서 부분반응, 18명(75.0%)은 안전 병변이 확인, 객관적 반응률은 12.5%, 질병조절률은 87.5%로 보고됐다.
반응지속기간 중앙값은 4.4개월로, 투약 주기 중앙값은 8주기였으며, 치료지속기간 중앙값은 5.2개월, 무진행생존기간 중앙값은 5.6개월, 전체 생존기간 중앙값은 14.0개월로 집계됐다.
이상반응에 있어서는 티쎈트릭과 아바스틴 병용군에서 치료관련 이상반응이 25.0%로 높게 나타났으나, 모두 1, 2등급으로 관리가 가능한 수준이었다.
이와 관련, 연구진은 티쎈트릭과 아바스틴 병용요법이 PD-L1 음성이 주를 이룬 환자들에서 객관적 반응률과 무진행 생존율, 전체 생존율 등의 측면에서 유망한 결과를 보였다고 의미를 부여했다.
나아가 이 조합이 이전 치료 경험이 있는 비소세포폐암 환자 중 티쎈트릭 단독요법에 반응하지 않은 환자에서 새로운 치료 전략이라는 것을 보여준다고 덧붙였다.
조윤경 IBS 첨단연성물질 연구단 그룹리더팀 연구
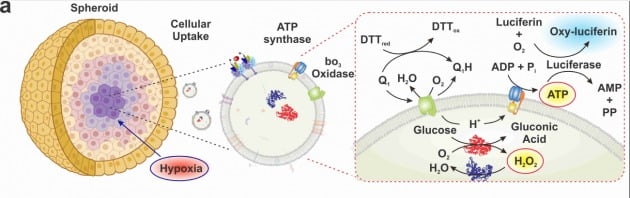
기초과학연구원(IBS)은 14일 손상 세포에 에너지를 공급하는 인공 엑소좀을 개발했다고 밝혔다.
조윤경 IBS 첨단연성물질 연구단 그룹리더팀은 엑소좀을 리프로그래밍해 세포 내에서 에너지 생성이 가능하도록 개발했다. 엑소좀은 세포 간 정보전달을 담당하는 소기관이다. 조직의 깊은 곳까지 침투할 수 있어 유용한 차세대 약물전달시스템(DDS)으로 주목받고 있다.
이번에 개발된 '인공 엑소좀(FEx-1)'은 두 개의 엑소좀을 융합해 개발됐다. 세포가 사용하는 에너지(ATP)를 만드는 데 필요한 생체 반응을 일으키기 위해서다. 연구진은 엑소좀의 막과 내부에 ATP를 만드는 데 관여하는 효소가 포함된 서로 다른 두 엑소좀(ATPsyn-CEx-GOx, bo3Oxi-CEx-HRP)을 융합했다.
이렇게 개발된 인공 엑소좀이 살아있는 세포 내에 들어가, 저산소 환경에서 손상된 세포에게 에너지를 공급해줄 수 있다. 연구진은 유방암 환경을 모사한 3차원 원형 조직(스페로이드)에서 인공 엑소좀이 조직 내부 깊숙한 부분까지 전달되는 것을 확인했다.
암세포가 잘 자라는 종양미세환경은 저산소 환경이다. 이를 감안하면 인공 엑소좀은 항암제를 효과적으로 전달하는 약물전달시스템으로서의 역할뿐만 아니라, 그 자체로 손상 세포를 살리는 약물로서의 가능성을 보여줬다.
조윤경 그룹리더는 "인공 엑소좀을 통해 살아있는 세포에 보다 효율적인 물질 전달 방법을 제시했다"며 "향후 엑소좀의 내부와 표면에 부가적인 기능을 탑재한 인공 세포 소기관을 만드는 연구를 계속할 예정"이라고 말했다.
이번 연구는 국제학술지 '네이처 카탈리시스' 9월 14일자에 실렸다.
美 제네릭 없는 특허만료약 451개
즉시 ANDA 가능한 것 311개...35개 신규 등재
미국에서 지난 상반기까지 제네릭 없는 특허 만료 의약품이 451개에 달하는 것으로 집계됐다.
이는 FDA가 제네릭 개발을 촉진하기 위해 지난 6월에 집계한 OPOE(Off-Patent, Off-Exclusivity Drugs without an Approved Generic) 목록에 따른 것.
이 가운데 사전 논의 없이 FDA가 즉시 제네릭 품목허가 신청(ANDA)을 받을 수 있는 파트 I에는 311개 항목이 있는 것으로 파악됐다.
반면 ANDA 제출 시 법적, 규제적, 과학적 문제를 일으킬 수 있어 사전에 FDA와 협의가 필요한 파트 II에는 133개가 포함됐다.
이밖에 작년 말 목록 작성 이후에 하나 이상의 ANDA가 승인된 7개 제품도 있었다.
파마콤파스가 최근 이를 1년 전 발표 목록과 비교했을 때 말레인산 레밤로디핀 등 35개가 새롭게 진입했다고 밝혔다.
" src="https://cdn.bosa.co.kr/news/photo/202109/2158326_189908_5717.png">
제형별로는 총 50종이 있었는데 약 1/3에 해당하는 153개가 주사제로 가장 많았고 이어 액상 제형이 70개였으며 각종 고형 경구 제형도 총 70개 정도로 나타났다.
덧붙여 최근 대체 가능한 바이오시밀러 인슐린 제품으로 처음 승인받은 심글리(Semglee, insulin glargine-yfgn)에도 파마콤파스는 주목했다.
동국제약, 반려견 치주질환 치료제 ‘캐니돌 정’ 출시
농림축산검역본부 품목허가 취득…반려견 치주질환·치은염에 효능·효과
동국제약(대표 오흥주)은 반려견 전용 치주질환 치료제 ‘캐니돌 정’을 출시했다고 14일 밝혔다.

동국제약 ‘캐니돌 정’<사진>은 치아지지조직질환과 치은염에 효능·효과가 있는 동물의약품으로, 지난해 4월 농림축산검역본부로부터 품목허가를 받았다.
미국수의치과협회(AVDS) 자료에 따르면 생후 3년 이상인 반려견의 80%가 치주질환을 경험하며, 치아 관리만 잘해줘도 수명이 20~30% 연장된 것으로 나타났다. 또한, 한국펫사료협회 조사결과에서는 질병 치료를 위해 동물병원에 방문한 원인으로 구강 질환이 2위를 기록했다.
‘캐니돌 정’은 생약성분인 옥수수불검화정량추출물과 후박추출물이 함유돼, 이들 성분이 시너지 효과를 발휘해 잇몸 겉과 속에 한 번에 작용한다. 옥수수불검화정량추출물은 잇몸뼈 형성을 촉진 및 치주인대 강화 작용을 도우며, 후박추출물은 다양한 과학적 연구를 통해 잇몸병을 유발시키는 치주병인균에 대한 항균 및 항염 효과가 입증됐다. 또한, 생약성분이라 장기간 관리가 필요한 반려견의 잇몸병 치료 및 예방에 더욱 효과적이라는 것이 동국제약의 설명이다.
‘캐니돌 정’의 임상실험 결과에 따르면, 치주질환으로 내원한 반려견 40마리에 대해 스케일링 직전과 스케일링 이후 4주 및 8주에 각각 치은지수와, 출혈지수에서 임상지표가 개선된 것으로 확인됐다.
동국제약 관계자는 “이번 캐니돌 정 출시를 시작으로 가족 같은 반려동물들의 건강을 위해 앞으로도 동물용 의약품뿐만 아니라 헬스케어 관련된 다양한 제품들을 선보일 예정”이라고 말했다.
국립암센터, 암단백체학 암과학포럼 성료
암단백체 분야의 다학제적 연구방법과 발전방향 논의
국립암센터(원장 서홍관)는 지난 9월 10일(금) 국가암예방검진동 국제회의장에서 암단백체학에 관한 2021년 제2차 암과학포럼을 성황리에 마쳤다.
‘암단백체학 임상 적용의 전망’이라는 주제로 열린 이번 포럼에서는 정부, 학계, 기업 등 각 분야의 전문가 등이 참석한 가운데 암단백체 분야의 다학제적 연구방법과 발전방향을 논의하기 위해 마련됐다.
포럼 1부에는 기조연설자로 미국 국립암연구소(NCI, National Cancer Institute) 임상암단백체분석컨소시엄(CPTAC, Clinical Proteome Tumor Analysis Consortium) 헨리 로드리게즈(Henry Rodriguez) 박사가 단백유전체 연구를 선도하는 미국 CPTAC과 단백유전체 기반의 정밀의료 전망에 대해 발표했다. 또한, 베르티스 최고과학이사(Chief Science Officer) 유명희 박사가 임상 암단백체학의 과거, 현재와 미래에 대해 조망했다.
이어 이상원 고려대학교 유전단백체연구센터장은 국제적인 수준에 도달한 국내 인산화단백체분석 플랫폼 기술 현황을 소개했다. 김광표 경희의과학연구원 멀티오믹스연구소장은 치료표적 발굴에의 활용에 대해 발표했다.
김학균 국립암센터 항암신약신치료기술개발사업단 부단장은 현재 단백체학 분석이 선별검사로 활용되고 있는 연구자주도 임상시험의 현황을 소개하면서 향후 전국 규모의 다기관 임상시험으로 이같은 임상시험을 확대하여 희귀난치암 환자의 치료 기회 확대를 도모하는 계획을 발표했다.
이혜승 서울대학교 의과대학 병리학교실 교수는 조직 내에서 위치정보를 유지하며 단백질 발현을 분석하는 방법론의 장점을 설명하고 이에 대한 다양한 최신 검사기법들의 현황을 소개했다.
마지막으로 박종배 국립암센터 암단백유전체연구사업단장은 International Cancer Proteogenome Consortium(ICPC) 암단백유전체 연구를 위한 글로벌 선도그룹의 연구 컨소시엄을 소개하며, 이를 통한 향후 국내 단백유전체 연구 플랫폼 구축과 차기 정밀의료의 글로벌리더로서 도약을 위한 방안에 대해 발표했다.
2부 패널토론에는 ▲ 유명희 ㈜베르티스 최고과학이사(CSO) ▲조제열 한국단백체학회장 ▲김선영 국가생명연구자원정보센터(KOBIC) 센터장 ▲신영기 서울대학교 약학대학 교수 ▲안영욱 식품의약품안전평가원 의료기기심사부 체외진단기기과 연구관 ▲김우석 보건복지부 보건의료정책실 질병정책과 사무관이 참여해 토론을 이어나갔다.
발표자와 패널들은 단백체분석기술의 빠른 발전으로 이제 임상시료의 분석에 있어서 재현성은 거의 문제되지 않는 수준에 이르렀으며, 이를 치료제 임상시험에 활용하는 희귀난치암 극복 국민희망 프로젝트 예비타당성조사 기획연구가 국가연구개발에 도약의 전기를 마련하는 결과를 창출할 것이라고 의견을 모았다.
김영우 국립암센터 연구소장은 "암과학포럼을 통해 국내의 많은 암 연구자들이 향후 암단백체가 갖는 중요성과 의미를 생각하게 하는 중요한 전기가 마련되었다”고 말했다. “또한, 희귀난치암 환자들에게 희망을 주기 위해서는 국가적인 임상 연구 네트워크와 함께 자원을 표준화하고 공유하는 협력 체계를 갖추어야 함을 공감하는 의미 깊은 시간이었다”라고 덧붙였다.
한편, 암과학포럼은 국내 암 전문가 집단의 원활한 교류와 협력의 장을 마련하고자 올해 두 번째로 개최됐다. 앞으로 국립암센터는 암과학포럼을 지속적으로 개최하여 정부와 민간, 기업과 학계 간의 연구 협력 및 최신지견을 공유하기 위한 소통의 장을 마련해 나갈 계획이다.
FDA, 마이펨브리 자궁내막증 환자 치료제로 심사
미국 식품의약국(FDA)이 자궁근종 치료제 마이펨브리(Myfembree)를 자궁내막증과 관련된 통증 치료제로 심사하기로 했다.
▲ 마이오반트와 화이자의 마이펨브리는 미국에서 자궁내막암과 관련된 중등도에서 중증 통증 관리를 위한 치료제로 심사된다.
마이오반트 사이언스와 화이자는 지난 9일(현지시각) FDA가 마이펨브리(렐루골릭스 40mg, 에스트라디올 1mg, 노르에틴드론 아세트산염 0.5mg)에 대한 적응증 추가 승인 신청을 접수하고 자궁내막증과 관련된 중등도에서 중증 통증 관리를 위한 약물로 심사하기로 했다고 발표했다.
전문의약품신청자수수료법(PDUFA)에 따른 승인 심사 기한은 내년 5월 6일까지로 정해졌다.
이 적응증 추가 신청은 24주 동안 자궁내막증과 관련된 통증을 앓는 여성 1,200명 이상을 대상으로 실시된 다국적, 반복, 중추적인 임상시험 SPIRIT 1 및 SPIRIT 2와 개방표지 연장 연구를 포함한 임상 3상 SPIRIT 프로그램의 결과에 의해 뒷받침된다.
마이오반트 사이언스의 후안 카밀로 아르호나 페레이라 최고의료책임자는 “자궁내막증이 있는 여성은 종종 일상생활에 영향을 미치는 쇠약하게 하는 증상을 경험한다. 불행히도 많은 여성은 현재 이용 가능한 의료 옵션으로 안도감을 얻지 못한다”고 설명했다.
그러면서 “이 적응증이 승인될 경우 마이펨브리가 자궁내막증을 앓는 여성에게 효과적인 알약 한 알의 1일 1회 치료 옵션으로서 치료를 재정의할 잠재력이 있다고 믿는다”고 밝혔다.
화이자 글로벌제품개발부 내과ㆍ병원부문 최고개발책임자 제임스 러스낙 수석부사장은 “자궁내막증 통증 치료를 위한 마이펨브리의 추가 승인신청서 제출은 여성 건강에서 충족되지 않은 상당한 수요가 있는 분야를 해결하겠다는 자사의 약속을 반영한다”며 “잠재적으로 이 중요한 새 치료 옵션을 자궁내막증이 있는 여성에게 제공하길 기대한다”고 말했다.
현재 미국에서 마이펨브리는 폐경 전 여성에서 자궁근종과 관련된 월경과다 관리를 위해 최대 24개월의 치료기간으로 사용되고 있다. FDA는 올해 5월에 임상 3상 LIBERTY 프로그램의 데이터를 근거로 마이펨브리를 처음 승인했다.
마이오반트와 화이자는 미국에서 마이펨브리를 공동으로 개발하고 상업화하고 있다.


 졸겐스마(척수성 근위축증 치료제·사진) 25억원, 킴리아(혈액암 치료제) 5억원, 빈다맥스(심근병증 치료제) 2억5000만원….
졸겐스마(척수성 근위축증 치료제·사진) 25억원, 킴리아(혈액암 치료제) 5억원, 빈다맥스(심근병증 치료제) 2억5000만원….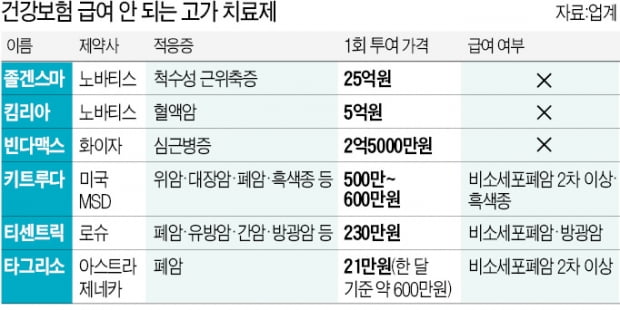





댓글목록