유럽에서 아스트라제네카의 코로나19 백신에 대해 희귀 신경 장애 부작용 가능성이 기재됐다. EMA는 아스트라 백신의 부작용으로 길랭-바레증후군(GBS)을 등재했다.
이에 따르면 지난 7월까지 세계적으로 접종된 5억9200만회 백신 가운데 GBS는 833건이 보고돼 인과관계에 적어도 합당한 가능성이 있다. 단, 그 빈도는 가장 낮은 정도로 극히 드문 것으로 평가됐다.
이와 관련, 미국에서는 이미 얀센의 백신이 가능한 부작용으로 GBS 경고를 받은 바 있다. 아스트라와 얀센 백신 모두 바이러스 벡터 기술을 이용해 만들어졌으며 희귀 혈전과도 관계를 보였다
GSK 코로나19 치료제 '소트로비맙' 日 신청
산소요법 불필요하고 중증화 위험 높은 경증·중등도 환자 대상
글락소스미스클라인(GSK)은 6일 단클론항체 '소트로비맙'(sotrovimab)을 일본에서 코로나19 치료제로 승인신청했다고 발표했다.
GSK는 특례승인 적용을 희망하고 있으며 산소요법이 필요하지 않고 중증화 위험이 높은 경증 및 중등도 환자가 대상이다.
소트로비맙은 GSK와 미국 비어 바이오테크놀로지가 개발한 코로나19 단클론항체로, 정상세포에 대한 바이러스의 침입을 막는 동시에 감염세포를 제거하는 능력을 높일 가능성이 있는 것으로 시사되고 있다.
해외에서 실시한 2/3상 임상시험에서는 입원하지 않은 경증~중등도 환자 1057명을 대상으로 투여 29일째까지 입원 및 사망한 비율을 비교검토한 결과, 위약 투여그룹에 비해 소트로비맙 투여그룹에서 79% 감소하고 주요평가항목을 달성한 것으로 확인됐다.
GSK에 따르면 미국 국립보건원(NIH)은 6월 코로나19의 치료지침을 개정하고 중증화 위험이 높은 입원하지 않은 경증~중등도 환자에 대한 소트로비맙 투여를 권장했다. 또 델타주, 람다주 등 변이주에 대해서도 활성을 유지하는 것으로 보고 있다.
소트로비맙은 미국에서 긴급사용승인을 취득했으며, 유럽의약품청(EMA) 의약품평가위원회(CHMP)로부터는 과학적으로 긍정적인 입장이 도출됐다. 또 캐나다, 이탈리아, 아랍에미리트, 싱가포르 등에서는 일시적 승인, 호주에서는 승인을 취득했다.
[WCLC 2021] 임핀지+트레멜리무맙, 전이성 폐암 사망위험 23%↓
PD-L1 항체 임핀지(성분명 더발루맙)와 CTLA-4 항체 트레멜리무맙이 전이성 폐암 환자의 사망 위험을 20% 이상 줄인 것으로 나타났다.
세계폐암학회 국제학술회의(WCLC 2021)에서는 1013명의 전이성 비소세포폐암 환자를 대상으로 진행한 다국가, 무작위 배정, 레이블 공개 3상 임상 POSEIDON의 최종 전체 생존(Overall Survival, OS) 데이터가 공개됐다.
▲ PD-L1 항체 임핀지(성분명 더발루맙)와 CTLA-4 항체 트레멜리무맙이 전이성 폐암 환자의 사망 위험을 20% 이상 줄인 것으로 나타났다.
모집단은 EGFR 또는 ALK 변이가 없는 환자들로, 전이 질환에 대한 치료 경험이 없고 전신수행능력(ECOG PS) 0 또는 1인 4기 비소세포폐암 환자들이었다.
환자들은 각각 ▲3주 간격의 백금기반 항암화학요법을 최대 6주기까지 투약한 후 질병이 진행될 때까지 메페트렉시드로 치료를 이어간 그룹(이하 항암화학요법군)과 ▲3주 간격으로 임핀지와 3주 간격의 항암화학 병용요법을 받은 후 질병이 진행할 때 까지 4주 간격의 임핀지와 페메트렉시드를 투약한 그룹(이하 임핀지 병용군), ▲여기에 더해 16주 차에 트레멜리무맙을 추가한 그룹(이하 임핀지ㆍ트레멜리무맙 병용군)에 각각 1대 1대 1로 배정됐다.
또한 이 연구에서는 추가 분석을 위해 환자들을 PD-L1 발현율(종양세포 50% 이상, 미만)과 병기(4A, 4B), 조직학적 분류(편평, 비평편)로 계층화했다.
연구의 1차 평가변수는 독립적 검토위원회(Blinded independent central review, BICR)가 평가한 임핀지 병용군 대비 항암화학요법군의 무진행 생존율(Progression-Free Survival, PFS) 및 전체생존율로 설정했다.
또한 2차 평가변수는 독립적 검토위원회가 평가한 임핀지ㆍ트레멜리무맙 병용군 대비 항암화학요법군의 무진행 생존율과 전체생존올, 종양변이부담(Tumor Mutational Burden, TMB) 20mut/Mb 이상인 환자에서의 전체생존율이었다.
여기에 추가 2차 평가변수로 객관적 반응률(Objective Response Rate, ORR)과 반응 지속기간(Duration of Response, DoR), 12개월 시점의 무진행 생존율, 건강 관련 삶의 질(Health-Related Quality of Life, HRQoL), 안전성과 내약성 등을 설정했다.
▲ 임핀지와 트레멜리무맙, 항암화학 병용요법은 전이성 비소세포폐암 환자에서 항암화학 단독요법에 비해 무진행 생존율과 전체 생존율 모두를 의미있게 개선했다.
연구 결과 1차 평가변수인 임핀지 병용군 대비 항암화학요법군의 무진행 생존기간 중앙값은 각각 5.5개월과 4.8개월, 12개월 시점의 무진행 생존율은 24.4%와 13.1%로 임핀지 병용군의 질병 진행 또는 사망의 위험이 26% 낮았다.(HR=0.74, P=0.00093, 중앙 추적관찰 10.3개월)
또한 전체 생존기간 중앙값은 각각 13.3개월과 11.7개월, 24개월 시점 전체 생존율은 29.6%와 22.1%로 역시 임핀지 병용군의 사망 위험이 14% 적었으나 통계적으로는 차이가 없었다.(HR=0.86, p=0.7581, 중앙 추적관찰 34.9개월)
2차 평가변수인 임핀지ㆍ트레멜리무맙 병용군과 항암화학요법군의 무진행 생존기간은 각각 6.2개월과 4.8개월, 12개월 시점 무진행 생존율은 26.6%와 13.1%로 임핀지ㆍ트레멜리무맙 병용군의 질병진행 또는 사망 위험이 28% 낮았다.(HR=0.72, P=0.00031, 중앙 추적관찰 10.3개월)
전체생존기간 중앙값은 14.0개월과 11.7개월, 24개월 시점 전체 생존율은 32.9%와 22.1%로 역시 임핀지ㆍ트레멜리무맙 병용군의 사망 위험이 23% 적었다.(HR=0.77, P=0.00304, 중앙추적관찰 34.9개월)
하위그룹 분석에서는 대부분 항암화학요법군보다 임핀지 병용군이나 임핀지ㆍ트레멜리무맙 병용군에 우호적이었다.
특히 임핀지ㆍ트레멜리무맙 병용군에서 항암화학요법군과 비교한 통계적 차이가 임핀지 병용군보다 항암화학요법군과이 차이보다 더 뚜렷했다.
다만, 흡연력이 없는 환자에서는 오히려 임핀지ㆍ트레멜리무맙 병용군보다 항암화학요법군에 우호적인 경향이 나타났다.
객관적 반응률은 임핀지 병용군이 41.5%, 임핀지ㆍ트레멜리무맙 병용군은 38.8%, 항암화학요법군은 24.4%였으며, 이에 따른 항암화학요법군 대비 임핀지 병용군의 오즈비는 2.26, 임핀지ㆍ트레멜리무맙 병용군은 2.00으로 임핀지 병용군이 오히려 더 우월한 경향을 보였다.
그러나 반응 지속기간 중앙값은 임핀지ㆍ트레멜리무맙 병용군이 9.5개월로, 임핀지 병용군의 7.0개월과 항암화학요법군의 5.1개월보다 더 길었다.
12개월 시점에 반응이 유지된 환자의 비율 역시 임핀지ㆍ트레멜리무맙 병용군이 49.7%, 임핀지 병용군은 38.9%, 항암화학요법군은 21.4%로 임핀지ㆍ트레멜리무맙 병용군이 가장 높았다.
조직학적 분류 중 비편평세포암 환자에 대한 분석에서는 임핀지 병용군의 무진행 생존기간 중앙값이 6.4개월, 임핀지ㆍ트레멜리무맙 병용군은 6.8개월, 항암화학요법군은 5.5개월로 항암화학요법 대비 임핀지 병용군의 질병 진행 또는 사망의 위험이 23%(HR=0.77), 임핀지ㆍ트레멜리무맙 병용군은 34%(HR=0.66) 낮았다.
객관적 반응률은 임핀지 병용군이 44.3%, 임핀지ㆍ트레멜리무맙 병용군은 45.5%로 큰 차이가 없었으나, 항암화학요법군은 23.7%로 절반 수준에 그쳤고, 반응지속기간 중앙값은 각각 10.6개월과 16.4개월, 6.0개월로 임핀지ㆍ트레멜리무맙 병용군이 가장 길었다.
전체 생존기간 중앙값 또한 임핀지 병용군이 14.8개월, 임핀지ㆍ트레멜리무맙 병용군은 17.2개월, 항암화학요법군은 13.1개월로 항암화학요법대비 임핀지 병용군의 사망 위험이 18%(HR=0.82), 임핀지ㆍ트레멜리무맙 병용군은 30%(HR=0.70) 낮았다.
편평세포암에서는 임핀지 병용균의 무진행 생존기간 중앙값이 4.7개월, 임핀지ㆍ트레멜리무맙 병용군은 4.6개월, 항암화학요법군은 4.6개월로 큰 차이를 보이지 않았다.
그러나 항암화학요법대비 상대위험비(Hazard Ratio HR)는 임핀지 병용군이 0.68, 임핀지ㆍ트레멜리무맙 병용군은 0.77로 임핀지 병용군의 질병 진행 또는 사망의 위험이 임핀지ㆍ트레멜리무맙 병용군보다 더 큰 차이를 보였다.
객관적 반응률 역시 임핀지 병용군이 37.3%로 임핀지ㆍ트레멜리무맙 병용군의 27.4%나 항암화학요법군의 25.6%보다 높았다.
하지만, 반응 지속기간 중앙값은 임핀지 병용군이 5.5개월, 임핀지ㆍ트레멜리무맙 병용군은 5.6개월로 차이가 없었으며, 항암화학요법군은 4.8개월에 그쳤다.
전체 생존기간 중앙값은 임핀지 병용군이 11.5개월로 임핀지ㆍ트레멜리무맙 병용군의 10.4개월이나 항암화학요법군의 10.5개월보다 조금 더 길었으며, 항암화학요법 대비 상대위험비는 임핀지 병용군이 0.84%, 임핀지ㆍ트레멜리무맙 병용군은 0.88로 집계됐다.
치료와 관련한 3/4등급 이상반응은 임핀지ㆍ트레멜리무맙 병용군이 51.8%로 임핀지 병용군의 44.6%나 항암화학요법군의 44.4%보다 조금 더 높았다.
심각한 이상반응 역시 임핀지ㆍ트레멜리무맙 병용군이 27.6%로 임핀지 병용군의 19.5%, 항암화학요법군의 17.7%보다 많았다.
이상반응으로 인한 치료 중단은 임핀지ㆍ트레멜리무맙 병용군이 15.5%, 임핀지 병용군은 14.1%로 비슷했으며, 항암화학요법군은 9.9%로 집계됐다.
치료로 인한 사망은 임핀지ㆍ트레멜리무맙 병용군이 3.3%, 임핀지 병용군은 2.1%, 항암화학요법군은 2.4%였다.
이와 관련, 연구 결과를 발표한 미국 사라 캐논 연구소 멜리사 존슨 박사는 전이성 폐암 1차 치료에서 임핀지와 항암화학 병용요법이 항암화학 단독요법에 비해 무진생 생존율은 크게 개선했지만, 전체 생존율은 통계적인 의미에 도달하지 못했다고 평가했다.
반면, 같은 환자군에서 임핀지와 트레멜리무맙, 항암화학 병용요법은 항암화학 단독요법에 비해 무진행 생존율과 전체 생존율 모두를 의미있게 개선했다고 밝혔다.
또한 이상반응은 모든 그룹에서 비슷하게 나타났으며, 새롭게 확인된 이상반응은 없었고, 트레멜리무맙을 추가한 그룹이 치료 중단을 의미있게 증가시키지도 않았다고 분석했다.
이에 존슨 박사는 “임핀지+트레멜리무맙+항암화학 병용요법은 전이성 비소세포폐암 1차 치료의 새로운 옵션으로서 가능성을 보여준다”고 평가했다.
[WCLC 2021] 키트루다, 타그리소 치료 실패 환자에 새로운 대안
타그리소 치료 환자 85% 포함 EGFR TKI 실패 환자에 가능성 확인
ALK TKI 치료 실패 환자에서는 효과 미미
키트루다(성분명 펨브롤리주맙, MSD)가 타그리소(성분명 오시머티닙, 아스트라제네카) 투약 환자들이 주를 이룬 EGFR TKI 치료 실패 환자 대상 임상 2상에서 긍정적인 결과를 도출해 귀추가 주목된다.
3세대 EGFR 표적치료제인 타그리소는 이전 세대 표적치료제들과 비교해 크게 개선된 유효성을 자랑하고 있다.
국내에서는 1차 치료에 건강보험이 적용되지 않아 제한적으로 사용되고 있지만, 미국에서는 이미 거의 대부분의 환자들이 타그리소로 1차 치료를 받고 있다는 연구 결과도 발표됐다.
그러나 타그리소를 1차 치료제로 사용할 경우 치료에 실패하면 아직까지 마땅한 대안이 없어 논란이 되고 있다.
타그리소 치료 실패후 대안이 없다보니, 1, 2세대로 치료후 타그리소로 치료를 이어가는 것과 타그리소로 1차 치료를 받는 것 중 어느 쪽이 유리한지 여전히 답을 얻지 못하고 있는 것.
이에 국내에서 개발된 3세대 표적치료제 렉라자(성분명 레이저티닙, 유한양행)와 이중 항체 라이브레반트(성분명 아미반타맙, 얀센) 병용요법 등이 대안으로 제시되고 있지만, 허가 단계에 이른 대안은 아직 나오지 않은 상황.
8일 개막한 세계폐암학회 국제학술회의(WCLC 2021)에서는 2세대 표적치료제인 지오트립(성분명 아파티닙, 베링거인겔하임)을 타그리소와 병용하는 임상도 공개됐지만, 성적은 신통치 않았다.
이 가운데 키트루다와 백금기반 항암화학 병용요법이 타그리소 치료 환자가 85%에 이르는 EGFR TKI 치료 실패 환자에서 가능성을 보여 이목을 끌고 있다.
▲ 키트루다(성분명 펨브롤리주맙, MSD)가 타그리소(성분명 오시머티닙, 아스트라제네카) 투약 환자들이 주를 이룬 EGFR TKI 치료 실패 환자 대상 임상 2상에서 긍정적인 결과를 도출해 귀추가 주목된다.
미국 미시건대학 쉬라이쉬 갓길 교수는 9일, 세계폐암학회 국제학술회의(WCLC 2021)에서 EGFR 또는 ALK 표적치료 후 재발한 비소세포폐암 환자들을 대상으로 키트루다와 백금기반 항암화학요법의 안전성과 유효성을 평가한 임상 2상 결과를 공개했다.
키트루다와 같은 항PD-1 또는 항PD-L1 면역항암제들은 EGFR 또는 ALK 등 표적 유전자 변이가 있는 경우 표적치료제에 비해 치료성적이 좋지 않아 허가사항에 포함되어 있지 않다.
하지만, EGFR 또는 ALK 변이 양성 비소세포폐암 역시 표적치료 이후에는 마땅한 대안이 없으며, 백금기반 항암화학요법은 반응률(Response Rate, RR)이 약 30%, 무진행 생존기간은 5개월 내외로 효과가 크지 않다.
이에 연구진은 이전에 EGFR 또는 ALK TKI로 치료했지만 재발한 환자들을 대상으로 키트루다의 가능성을 타진했다.
모집된 환자들 중 일부는 PD-L1 발현율과 함께 혈중 순환종양세포(Circulating Tumor Cell, CTC) 검사를 시행했다.
이어 키트루다와 카보플라틴, 페메트렉시드를 4주기 동안 투약한 후 키트루다와 페메트릭시드 유지요법을 2년간 시행했다.
▲ 이와 관련, 갓길 교수는 EGFR 양성 환자에서 확인된 유효성 데이터를 긍정적으로 평가하면서, 이 연구가 재발한 EGFR 양성 비소세포폐암 환자에서 키트루다와 항암화학 병용요법의 추가 연구를 보장한다고 평가했다.
연구의 1차 평가변수는 고형종양평가기준(Response Evaluation Criteria In Solid Tumors. RECIST) 1.1에서 정의된 반응률이었으며, 2차 평가변수는 무진행 생존율(Progression-Free Survival, PFS)과 전체생존율(Overall Survival, OS)이었다.
연구에 참여한 환자는 총 33명으로, EGFR 변이 양성 환자가 26명, ALK 양성은 7명이었다.
EGFR 변이 양성 환자 중 이전에 1 차례 치료를 받은 환자가 61%(16명), 2차례 이상이 39%(10명)였으며, 이전에 타그리소 치료 경험이 있는 환자는 85%(22명)에 달했다.
ALK 양성 환자에서는 71%(5명)이 1차례 치료 경험이 있었고, 29%(2명)은 2차례 이상 치료를 경험했다.
연구 결과 EGFR 양성 환자에서 반응률은 42.3%(11명), ALK군에서는 28.6%(2명)으로 집계됐다.
또한 EGFR 양성 환자에서 무진행 생존시간 중앙값은 8.3개월, 12월 시점 무진행 생존율은 29%로 집계됐으나, ALK 양성 환자는 무진행 생존기간 중앙값이 2.9개월, 12개월 시점 무진행 생존율은 14%에 그쳤다.
전체 생존 관련 데이터 역시 EGFR 양성 환자는 전체 생존기간 중앙값이 22.2개월, 12개월 시점의 전체생존율은 76%에 달했던 반면, ALK 양성 환자는 전체 생존기간 중앙값이 2.9개월, 12개월 시점 전체생존율은 14%에 불과했다.
PD-L1 발현율에 따른 분석에서는 음성인 경우(0%)와 양성인 경우(1% 이상) 모두 무진행 생존기간 중앙값이 6개월이었으며, 12개월 시점 무진행 생존율은 음성인 경우 10%, 양성인 경우에는 31%로 집계됐지만 통계적으로 유의미한 차이는 없었다.
전체 생존율 역시 PD-L1 음성인 경우 전체 생존기간 중앙값이 22개월, 양성인 경우는 21개월로 차이가 거의 없었고, 12개월 시점 전체생존율도 54%와 58%로 통계적 차이가 나타나지 않았다.
이어 연구진은 EGFR 양성 환자 중 15명에게서 진행한 순환종양세포 검사를 기준으로 생존율을 분석했다.
검사는 초반 1~3주기에 시행했는데, 기저시점에 순환종양세포가 검출된 EGFR 양성 환자는 검사자 중 14명(93%)으로 평균 4개(ml당)의 순환종양세포가 검출됐다.
이를 기준으로 전체 생존율을 분석한 결과, 기저시점에 4개 이하의 순환종양세포가 검출된 8명 중에서는 4명이 사망했으며, 중앙 전체생존 기간은 22개월로 집계됐다. 반면, 4개 이상 검출된 7명은 모두 생존해 있었다.
뿐만 아니라 1주기에서 3주기 사이에 CTC 개수가 증가한 7명 중 2명이 사망, 중앙 전체생존기간은 18.5개월로 집계됐으나, 감소한 환자 3명은 모두 생존해 있었다.
이와 관련, 갓길 교수는 EGFR 양성 환자에서 확인된 유효성 데이터를 긍정적으로 평가하면서, 이 연구가 재발한 EGFR 양성 비소세포폐암 환자에서 키트루다와 항암화학 병용요법의 추가 연구를 보장한다고 평가했다.
[WCLC 2021] 옵디보ㆍ티쎈트릭, 뇌 전이 폐암에 가능성 확인
옵디보+여보이+항암화학요법, 항암화학 단독 대비 사망위험 57% 감소
면역항암제 옵디보(성분명 니볼루맙, 오노ㆍBMS)와 티쎈트릭(성분명 아테졸리주맙, 로슈)가 나란히 뇌전이 폐암 환자 1차 치료에서 가능성을 확인했다.
8일 개막한 세계폐암학회 국제학술회의(WCLC 2021)는 2일차(9일)을 맞이해 진행성 비소세포폐암에서 면역항암제들의 새로운 가능성을 확인하는 자리를 마련했다.
▲ 면역항암제 옵디보(성분명 니볼루맙, 오노ㆍBMS)와 티쎈트릭(성분명 아테졸리주맙, 로슈)가 나란히 뇌전이 폐암 환자 1차 치료에서 가능성을 확인했다.
특히 이 자리에서는 이전 치료경험이 없는 뇌 전이 폐암환자에서 옵디보와 티쎈트릭의 가능성을 확인한 연구가 연이어 발표돼 눈길을 끌었다.
이 가운데 미국 오하이오 주립대학 데이비드 폴 카본 교수는 진행성 비소세포폐암 환자를 대상으로 옵디보와 여보이(성분명 이필리무맙, 오노ㆍBMS)에 2주기의 항암화학요법을 더해 4주기 항암화학요법과 비교했던 CheckMate 9LA 연구 중 뇌전이 환자를 대상으로 한 하위분석 결과를 소개했다.
총 719명의 환자를 1대 1로 배정해 진행한 이 연구(3상)에서 옵디보+여보이+항암화학 병용요법 군(이하 옵디보군)은 2년 시점에서 38%의 환자가 생존, 항암화학 단독요법(대조군)의 26%와 비교해 사망의 위험이 28%(HR=0.72) 낮았다.
9일 공개된 뇌 전이 환자 하위분석에는 기저 시점에 뇌 전이가 있었던 환자 총 101명(옵디보 군 51명, 대조군 50명)과 기저 시점에는 뇌전이가 없었던 618명(옵디보군 310명, 대조군 308명)으로 구분, 전체 생존율(Overall Survival, OS)과 무진행생존율(Progression-Free Survival, PFS), 객관적 반응률(Objective Reponse Rate, ORR) 등을 평가했다.
또한 전신 안전성 및 유효성과 두개내 안전성 및 유효성(기저시점 뇌전이 환자)을 추가 분석했다.
연구 결과 기저시점에 뇌전이가 있었던 환자에서는 옵디보군의 전체생존기간 중앙값이 19.3개월로 대조군의 6.8개월보다 3배 가량 길었다.
24개월 시점에서 전체생존율은 옵디보군이 35%, 대조군이 12%로 옵디보군의 사망 위험이 57% 낮았다.(HR=0.43)
▲ CheckMate 9LA 하위분석 결과, 옵디보+여보이+2주기 항암화학요법은 항암화학 단독요법과 비교해 뇌전이 환자의 생존율을 크게 개선한 것으로 나타났다.
기저시점에 뇌전이가 없었던 환자에서도 옵디보군이 전체 생존기간 중앙값이 15.6개월로 대조군의 12.1개월보다 길었고, 24개월 시점 전체생존율도 39%와 29%로 옵디보군의 사망 위험이 21%(HR=0.79) 낮았으나 기전시점에 뇌전이가 있었던 환자들보다는 차이가 작았다.
무진행 생존율과 객관적 반응률, 반응지속기간(Duration of Response, DoR)에서도 비슷한 추세가 나타났다.
기저시점에 뇌전이가 있었던 환자에서는 옵디보군의 무진행 생존기간 중앙값이 10.6개월로 대조군의 4.1개월보다 두 배 이상 길었다.
2년 시점의 무진행 생존율은 19%와 6%로 세 배 이상 차이를 보이는 등, 옵디보군의 질병 진행 또는 사망의 위험이 60% 더 낮은 것으로 집계됐다.(HR=0.60)
기저 시점에 뇌전이가 있었던 환자에서는 옵디보군의 무진행 생존기간 중앙값이 5.8개월, 대조군이 5.4개월로 차이가 크지 않았으나, 2년 시점의 무진행 생존율은 20%와 8%로 두 배 이상 차이를 보였다.
또한 기저시점에 뇌전이가 있었던 환자들보다는 차이가 작았지만, 뇌전이가 없었던 환자들에서도 옵디보군의 질병 진행 또는 사망의 위험이 대조군보다 28%(HR=0.72) 낮았다.
객관적 반응률에서도 기저시점에 뇌전이가 있었던 환자들은 옵디보군이 43%, 대조군은 24%로 두 배 가까이 차이를 보였으며, 뇌전이가 없었던 환자들에서는 37%와 26%로 상대적으로 차이가 작았다.
반응지속기간 중앙값 역시 뇌전이가 있었던 환자들에서는 15.5개월과 4.4개월로 네 배에 가까운 차이를 보였으며, 뇌전이가 없었던 환자들에서도 13.0개월과 5.7개월로 두 배 이상 차이를 보였다.
한편, 기저 시점에 뇌전이가 있었던 환자들을 대상으로 분석한 두개내 무진행 생존기간 중앙값은 옵디보군이 13.5개월, 대조군이 5.6개월로 집계됐다.
24개월 시점에 옵디보군에서는 18%, 대조군은 11%가 무진행 생존, 옵디보군의 두개내 질병 진행 또는 사망의 위험이 64%(HR=36) 더 낮았으며, 두개내 반응률도 39%와 20%로 두 배 가까이 차이가 났다.
기저 시점에 뇌전이가 있었던 환자 중 새로운 뇌 병변으로 발전한 환자는 옵디보군이 16%로 대조군의 30%와 비교해 절반 수준에 그쳤고, 새로운 뇌 병변이 확인되기까지의 시간 중앙값도 9.0개월과 4.6개월로 두 배에 가까웠다.
기저 시점에 뇌전이가 없었던 환자에서는 새로운 뇌 병변으로 발전한 환자가 각각 2%와 4%에 불과했고, 새로운 뇌 병변이 확인되기까지 시간 중앙값은 6.9개월과 5.3개월로 집계됐다.
치료 지속기간 중앙값은 뇌전이가 있었던 환자에서 옵디보군이 7.1개월, 대조군은 2.4개월로 집계됐으며, 뇌전이가 없었던 환자에서는 옵디보군이 5.8개월, 대조군은 2.6개월이었다.
이와 관련 카본 교수는 “이 CheckMate 9LA 하위분석에서는 기저시점에 뇌 전이가 있거나 없는 진행성 비소세포폐암 환자에서 옵디보+여보이+2주기 항암화학 병용요법은 지속적인 생존 이득을 보여주었다”면서 “기저시점에 뇌전이가 있었던 환자에서는 옵디보+여보이+2주기 항암화학 병용요법의 두개내 유효성이 더 개선됐다”고 평가했다.
또한 “옵디보+여보이+2주기 항암화학 병용요법군에서는 새로운 뇌 병변으로 발전된 환자가 더 적었고, 새로운 뇌 병변으로 발전하기까지 시간도 더 길었다”면서 “기저시점에 뇌전이가 있었던 환자들에서 새롭게 관찰된 이상반응은 없었다”고 부연했다.
이어 “이 자료는 옵디보+여보이+2주기 항암화학 병용요법을 뇌 전이 환자를 포함해 진행성 비소세포폐암 환자의 효과적인 1차 치료옵션으로 더욱 지지한다”고 의미를 부여했다.
옵디보가 여보이라는 지원군을 등에 업고 뇌전이 환자의 예후를 개선했다면, 티쎈트릭은 항암화학요법과의 조합만으로 가능성을 보여줬다.
▲ 티쎈트릭+항암화학요법은 이전 치료 경험이 없는 뇌 전이 진행성 비소세포폐암에서 가능성을 확인했다.
스페인 카탈라 암 연구소의 어니스트 나달 박사는 이전 치료 경험이 없는 뇌 전이 진행성 비소세포폐암 환자 40명을 대상으로 티쎈트릭과 항암화학요법의 안전성과 유효성을 평가한 임상 2상 결과를 보고했다.
임상은 환자들 카보플라틴과 페메트렉시드에 티쎈트릭을 3주 간격으로 4~6차례 투약한 후 페메트렉시드와 티쎈트릭 병용요법을 3주 간격으로 종양이 진행하거나 독성을 견딜 수 없을 때까지 최대 2년간 투약할 수 있도록 설계했다.
연구의 1차 평가변수는 12주차의 안전성과 무진행 생존율 조합으로, 12주 시점에 19명(47.5%)에서 전신 반응이 있었으며, 중추신경계 반응은 16명(40%), 중추신경계 안전 병변(Stable Disease, SD)은 19명(47.5%)으로 집계됐다.
이 가운데 중추신경계와 전신 반응이 불일치하는 환자는 4명이었다.(뇌에 부분 질환이 있으나 신체에 부분 반응이 있는 환자 2명, 뇌에 안정 병병이 있으나 신체에 부분 질환이 있는 환자 2명)
12주 시점의 무진행 생존율은 60%, 3~4 등급 이상의 이상반응은 27.5%로 집계됐으며, 두개내 무진행 생존기간 중앙값은 6.9개월, 전신 무진행 생존기간 중앙값은 8.9개월이었다.
또한 18개월 시점의 두개내 무진행 생존율은 10.4%, 전신 무진행 생존율은 24.9%로 집계됐다.
2차 평가변수 가운데 최고 두개내 반응은 40%, 최고 전신 반응은 47.5%(ORR 기준)로 집계됐고, 전체생존기간 중앙값은 13.6개월, 2년 전체생존율은 32%였다.
대부분의 이상반응은 1, 2등급이었으며, 치명적인 부작용은 발생하지 않았다. 3명의 환자가 4등급 이상반응을 보였으며, 각각 혈소판감소증, 호중구감소증, 환각 등을 보고했다.
3등급의 이상반응은 빈혈(8명 20%), 등통증(4명, 10%), 혈소판감소증(2명 5%), 호흡곤란(1명, 3%), ALT 상승(1명, 3%), 폐렴(1명, 3%) 등이 보고됐다.
이와 관련 나달 박사는 “이 연구에서 확인된 12주 시점의 무진행 생존기간(6.9개월) 및 무진행 생존율(60%)이 키트루다의 KEYNOTE_189 연구 중 뇌전이 환자에서 보고된 무진행생존과 유사하다”고 의미를 부여했다.
또한 “2년 시점에서 32%의 환자가 생존해 있었다는 것은 이 조합이 임상적 이득을 제공할 수 있다는 것을 보여준다”고 강조했다.
WCLC 2021] WCLC, 입랜스 흉선암 치료 효과에 관심
세계폐암학회가 입랜스(성분명 팔보시클립, 화이자)의 흉선암 치료 효과에 주목했다.
8일, 세계폐암학회 국제학술회의(WCLC 2021)에서는 백금기반 항암화학요법에 실패한 흉망상피세포암 환자를 대상으로 대한항암요법연구회가 진행한 KCSG LU17-21 연구가 발표됐다.
앞서 이 연구는 지난 6월, 미국임상종양학회 연례학술회의(ASCO 2021)에서 포스터를 통해 공개된 바 있다.
세계폐암학회는 국제학술회의 첫날인 8일, ‘늑막중피종 및 흉선암의 현재와 전망’ 세션에 삼성서울병원 정현애 교수를 초청, 이 연구를 다시 한 번 조명했다.
▲ 삼성서울병원 정현애 교수는 8일, 세계폐암학회 국제학술회의(WCLC 2021) 중 ‘늑막중피종 및 흉선암의 현재와 전망’ 세션을 통해 흉선상피세포암 2차 치료에서 입랜스의 가능성을 제시했다.
흉선상피세포암은 희귀암으로 분류되지만, 전종격동 종양 중에서는 가장 흔한 암이다.
1차 표준요법인 백금기반 항암화학요법은 객관적 반응률(Objective Response Rate, ORR)이 50~90% 정도로 보고되고 있다.
그러나 백금기반 항암화학요법에 실패한 환자들에서는 아직까지 확립된 표준요법이 없으며, 인포스파마이드, 옥트레오타이드, 플루오로우라실 등 일부 약제가 10~30%의 객관적 반응률을 보고하고 있다.
이 가운데 연구진은 CDK4/6 억제제의 가능성에 주목했다. CDK4/6 억제제는 망막아종 단백질(pRB)의 인산화를 예방해 세포 주기를 차단, 암세포의 사멸을 유도한다.
흉선상피세포암에서는 약 95%에서 망막아종 단백질(RetinoBlastoma protein, pRB)이, 84%에서는 인산화된 pRB가 발현되는 것으로 보고되고 있어 CDK4/6 억제제의 가능성을 타진하고자 한 것.
총 48명의 환자를 대상으로 진행된 이 연구에서 약 70%의 환자가 60세 미만이었으며, 남성이 54.2%로 조금 더 많았다.
전신수행능력 점수(ECOG PS)는 1이 95.8%, 0이 4.2%였으며, 35%정도는 이전에 두 차례 이상 항암화학요법을 받은 환자들이었다.
중앙 추적관찰 기간 14.5개월 및 입랜스 투약 10주기(4주간격 3회) 시점에서 집계된 무진행 생존기간(Progression-Free Survival, PFS) 중앙값은 11.0개월, 전체 생존기간(Overall Survival, OS) 중앙값은 26.4개월이었다.
또한 반응률 평가가 가능했던 44명의 환자 중 6명에서 객관적 반응이 나타나 객관적 반응률(Objective Response Rate, ORR)은 13.6%로 집계됐다.
3등급 이상의 이상반응은 호중구감소증이 41.7%로 가장 흔했고, 빈혈이 14.6%, 혈소판감소증이 10.4%, 폐렴이 4.2%, ALT 상승이 2.1%에서 발생했다.
이에 대해 정현애 교수는 “팔보시클립 단독요법은 백금기반 항암화학요법에 실패한 흉선상피세포암 환자에서 유망한 효과와 좋은 내약성을 보였다”면서 “입랜스의 안전성과 유효성을 평가하기 위해 무작위대조 연구가 더 필요하다”고 의미를 부여했다.
[WCLC 2021] 한국에서 외면받는 타그리소, 미국은 압도적 지지
치료 유지율 높고 안전성도 유리...미국 이외 지역에서는 지오트립 비중 확대
미국의 EGFR 양성 4기 비소세포폐암 환자들은 거의 대부분 1차 치료제로 3세대 표적치료제 타그리소(성분명 오시머티닙)를 선택하고 있다는 설문 결과가 발표됐다.
타그리소는 지난 2016년 처음으로 EGFR 양성 비소세포폐암 1차 치료에서 안전성과 유효성을 확인했다.
이후 2019년에는 FLAURA 3상 최종 전체생존율(Overall Survival, OS) 보고에서 기존 1차 치료제보다 뛰어난 생존기간 연장 효과를 입증했다(OS HR=0.799, P=0.0462).
여기에 더해 지난해에는 EGFR 표적치료제(Tyrosine Kinase Inhibitor, TKI) 중 최초로 수술 후 보조요법에서도 안전성과 유효성을 입증하기도 했다.
그럼에도 불구하고, 국내에서는 FLAURA 연구 중 아시아인에 대한 하위분석을 근거로, 유효성이 부족하다며 1차 치료 적응증 확대 후 2년여가 지난 지금까지 급여 확대를 거부하고 있다.
이 가운데 LUNGEVITY 재단은 2019년과 2020년 EGFR 양성 비소세포폐암 환자를 대상으로 진행한 환자 보고 결과를 발표했다.
설문에서는 425명의 환자와 간병인이 기초 조사를 완료했으며, 추가로 127명의 환자가 장기 추적 평가를 완료했다.
▲ 미국의 EGFR 양성 4기 비소세포폐암 환자들은 거의 대부분 1차 치료제로 3세대 표적치료제 타그리소(성분명 오시머티닙)를 선택하고 있다는 설문 결과가 발표됐다.
응답자의 대부분은 여성(78%)이었으며, 65세 이하가 67%였고, 74%는 미국 거주자였다. 또한 대부분의 환자(84%)는 2015년~2019년 사이에 진단을 받았다.
설문 종료 시점에서 82%의 환자는 4기 비소세포폐암이라고 보고했으며, 거의 절반(48%)의 환자가 1차 치료만 시행했고, 25%는 2차 치료를, 23%는 3차 이상의 치료를 받았다고 밝혔다.
또한 4기 환자 가운데 83%는 1차 요법으로 TKI를 투여 받았으며, 이 가운데 타그리소를 투약한 환자가 43%로 가장 많았고, 엘로티닙(오리지널 제품명 타쎄바, 로슈)이 35%로 뒤를 이었다.
주로 미국 거주자들은 1차 치료제로 타그리소를 투약했으나, 이외의 지역에서는 그렇지 않았다는 것이 연구진의 분석이다.
실제로 연구진이 1차 치료에 사용한 TKI를 연도별로 분석한 결과, 미국에서는 타그리소의 비중이 2018년부터 급격하게 증가하는 모습을 보였다.
2017년까지 20%를 넘지 않았던 타그리소의 비중이 2018년 80%를 넘어섰고, 2019년에는 거의 100%에 근접했다. 1차 치료에서 타그리소 이외의 선택이 오히려 낯선 분위기다.
미국 이외의 지역에서는 2017년까지 거의 존재감이 없던 타그리소의 비중이 2018년 40% 가까이로 늘었지만, 2019년에는 30% 전후로 위축됐다.
반면 2017년 절반 가까이를 차지하다 2018년 10% 내외로 크게 줄어들었던 2세대 표적치료제 지오트립(성분명 아파티닙, 베링거인겔하임)의 비중은 2019년 다시 증가하는 양상을 보였다.
안전성과 유효성에 대한 평가에서도 타그리소에 우호적이었다. 진단 후 설문에 응하기까지의 시간에 큰 차이가 없음에도 불구하고, 1차 치료제로 타그리소를 선택한 환자의 64%가 치료를 유지하고 있는 것과는 달리, 엘로티닙을 선택한 환자는 17%에 그쳤다는 것.
▲ 안전성과 유효성에 대한 평가에서도 타그리소에 우호적이었다.
안전성에 있어서도 타그리소는 엘로티닙이나 지오트립에 비해 중등증에서 중증의 설사, 피부발진 등의 빈도가 적었다.
이와 관련, 연구진은 새로운 세대의 TKI가 질병 진행까지의 더 긴 시간을 제공하고, 가장 흔한 이상반응들에 있어서도 내약성이 더 우수한 것으로 보인다고 평가했다.
한편, 연구진은 이번 설문에서 2차 이상의 치료를 시행한 환자들 중 TKI 단독 요법 이외에도 항암화학요법 또는 방사선 치료를 TKI와 병용하거나, 아직까지 EGFR 양성 비소세포폐암에 허가되지 않은 면역항암제를 사용하는 사례도 확인됐다고 소개했다.
이는 비교적 최근에 진단된 환자들임에도 불구하고, EGFR 양성 비소세포폐암 진료지침이 처방에 잘 반영되지 않는다는 것을 보여주고 있다는 분석이다.
키트루다·렌비마의 동행...25개 암 대상 임상 46건
키트루다와 렌비마 병용요법이 20여개 암 극복을 위해 도전하고 있다. 또 암을 넘어 재발성 호흡기 유두종증(RRP) 치료까지 영역확장을 꾀한다.
6일 뉴스더보이스가 클리니컬트라이얼(clinicaltrials.gov)를 통해 MSD의 키트루다(펨브롤리주맙)와 에자이의 렌비마(렌바티닙) 병용요법 관련 46건의 임상시험을 분석했다. 현재 키투루다와 렌비마 병용요법은 FDA로 부터 자궁내막암과 신세포암에 대한 적응증을 확보했으며 추가적으로 약 25개 암종에 대한 가능성을 살피고 있다.
46건의 임상중 6건은 기본 임상시험을 종료하고 추적관찰과 검토종료, 또는 진행중에 있다. 현재 40건의 임상시험이 진행되고 있으며 이중 올해 시작됐거나 올해내 임상개시 예정인 임상은 모두 20건이다.
이중 MSD가 적응증 확대를 위해 진행중인 임상은 20건. 비소세포암, 소세포페암, 두경부암, 식도암, 간세포암, 결장직장암, 요로상피암, 난소암, 위암, 대장암, 교모세포종, 담도암, 췌장암 등 13개 암종이다.
적응증 확대 여부를 살피기 위한 3상 임상은 11건으로 간암(NCT03713593)과 비소세포페암(NCT03829332)의 기본연구가 내년에 완료된는 만큼 결과에 따라 적응증 추가 확대가 기대된다.
MSD 진행임상중 2건은 키트루다+콰본리맙 복합제와 렌비마의 병용요법에 대한 임상으로 키트루다 복합제 개발이 검토되고 있는 것으로 파악됐다. 임상은 신세포암(MK-6482-012/NCT04736706) 3상과 흑색종(MK-3475-02D/KEYMAKER-U02/NCT04700072) 1,2상이다.
또 에자이는 현재 확보한 병용요법 관련 임상시험을 이끌며 시작을 알렸다면 지난해 부터 MSD가 임상을 주도하는 흐름이다.
파일럿 등 소규모 임상연구가 진행되는 암종은 담관암, 메르켈 세포암종, 신경내분비암, 흉선암, 갑상선암, 자궁경부암, 침샘암, 연조직육종, 부인과 투명세포 선암종과 세포암종 등 12개 암종이다.
수술전후 보조요법, 1,2,3차요법 적응증 여부를 세분화하지 않은 암종구분으로 모두 약 25개 종양에 대해 임상을 진행중이다. 사실상 거의 모든 고형암종을 대상으로 진행되고 있다고 해도 과언은 아니다.
이외 암을 넘어서 HPV관련 재발성 호흡기 유두종증(RRP)의 치료 가능성을 살피는 2상 임상(NCT04645602)도 올해 12월 매사추세츠병원에서 시작될 예정이다.
키트루다와 렌비마 병용요법의 효과를 살피는 임상에 참여한 환자 만도 누적수치로 전세계 1만 4289명에 달한다.
이번 분석은 키트루다와 렌비마 병용요법 중심의 임상 46건(확대임상포함)을 기반으로 이뤄졌다. 다른 품목과와 다약제간 병용 임상시험건은 FDA 승인 관련 1건 이외 제외했다. 분석대상 임상은 다음과 같다.
한편 한국을 포함한 글로벌 임상은 7건이었으며 1건의 기본임상이 종료됐으며 6건이 진행중이다.
NCT04736706/NCT04700072/NCT04622566/NCT03895970/NCT04550624/NCT03609359/NCT04519151/NCT04869137/NCT04704219/NCT04710628/NCT03797326/NCT02501096/NCT04645602/NCT04199104/NCT03006926/NCT04729348/NCT04267120/NCT03321630/NCT04887805/NCT04745988/NCT04171622/NCT03898180/NCT04865887/NCT04976634/NCT04889118/NCT04209660/NCT03713593/NCT03829332/NCT04781088/NCT04784247/NCT03517449/NCT02973997/NCT04699071/NCT04246177/NCT04875585/NCT04865289/NCT04427293/NCT04776148/NCT03884101/NCT04716933/NCT02811861/NCT03829319/NCT04428151/NCT04949256/NCT04955743/NCT03516981
악성 뇌종양 재발 억제 약물 국내 연구진이 발견
부산대 윤부현 교수 연구팀…암 줄기세포 억제 효과
악성 뇌종양 재발을 효과적으로 억제할 수 있는 약물이 국내 연구진에 의해 발견됐다.
부산대 생명과학과 윤부현 교수 연구팀은 당뇨병 치료제 ‘글리메피리드’가 악성 뇌종양인 교모세포종의 암 줄기세포를 억제하는 효과가 있다는 것을 확인했다고 8일 밝혔다.
암 조직의 0.1∼5%를 차지하는 암 줄기세포는 항암 치료 후에도 살아 남아 암 세포를 재생할 수 있는 능력을 갖춘 세포를 말한다.
윤 교수 연구팀은 먼저 실험용 쥐를 대상으로 하는 실험에서 교모세포종을 방사선 치료하면 암 줄기세포에서 CLIP3 단백질의 양이 줄어드는 것을 확인됐다.
또 이 단백질 양이 줄면 암 줄기세포의 먹이가 되는 포도당을 옮기는 CLUT3라는 물질이 세포 안으로 쉽게 들어와 암세포가 활성화되는 구조를 밝혀냈다.
이어 약물 반응 유전체 프로파일 데이터베이스 분석을 통해 글리메피리드가 CLIP3 단백질 발현을 회복시킨다는 결과를 얻었다.
뇌종양 환자에게서 떼어낸 암 세포를 실험용 쥐에 이식해서 한 실험에서도 같은 결과가 나왔다.
방사선 치료와 글리메피리드 투여를 병행하면 암 줄기세포를 제어해 암 재발을 효과적으로 억제할 수 있다는 것이다.
현재 교모세포종 치료에 쓰는 약물인 테모졸로마이드와 비슷한 암 억제 효과가 있는 것으로 나타났다.
특히 테모졸로마이드는 저항성 때문에 환자의 절반가량에는 쓰지 못하지만, 글리메피리드는 모든 환자에게 쓸 수 있다는 장점이 있다.
또 글리메피리드는 이미 안정성이 검증돼 미국 식품의약국(FDA) 승인이 완료돼 신속한 임상 실험이 가능할 것으로 기대된다.
이 같은 연구 결과는 지난 6일 종양학 분야 국제 학술지인 ‘실험·임상 암 연구 저널’에 게재됐다.
부산대 생명시스템학과 박사 과정을 밟고 있는 강현구 씨가 제1 저자로, 연구 책임자인 윤 교수가 교신저자로 이름을 올렸다.
또 연세대 의대 강석구 교수와 인제대 해운대백병원 김해유 교수가 공동저자로 참여했다.
지긋지긋한 통증, 아편 쓰지 않는 진통제 개발 가능해졌다
만성 통증은 세계 보건·의료계가 큰 부담을 느끼는 현안 중 하나다.
통증 환자는 늘어나는데 치료 방법이 마땅치 않아, 아편을 쓰는 마약성 진통제에 많이 의존하는 게 현실이다.
그런데 이런 마약성 진통제는 효과가 제한적이고, 호흡 기능 저하나 약물 중독 같은 심각한 부작용을 유발한다.
만성 통증의 한 유형인 신경병성 통증(Neuropathic pain)도 마약성 진통제를 많이 쓰는 질환이다.
신경병성 통증은 신체 부상, 바이러스 감염, 다발성 경화증이나 당뇨병 합병증, 암 치료 등 여러 경로를 통해 올 수 있다.
이런 신경병성 통증을 안전하고 효과적으로 치료하는 비(非) 마약성 진통제 개발의 길이 열릴 것 같다.
비 마약성 진통제의 유력한 치료 표적인 아데노신 A1 수용체(adenosine A1 receptor)와 잘 결합하는 조절 인자가 발견된 것이다
호주 모내시대의 아서 크리스토풀로스(Arthur Christopoulos) 약학·제약과학 교수 연구팀이 수행한 이 연구 결과는 지난 8일(현지 시간) 저널 '네이처(Nature)'에 논문으로 실렸다
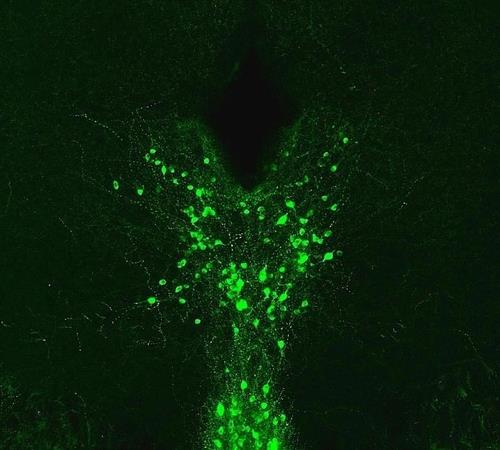
뇌의 도파민 활성 뉴런은, 의료용 아편제제가 통증을 완화할 때 핵심적인 역할을 한다.
이런 뉴런은 도파민과 함께 글루타민산염을 분비하는 것으로 알려졌다.
[UNC Medicine, Kash Lab / 재판매 및 DB 금지]
아데노신 A1 수용체는 오래전부터 신경병성 통증에 쓸 수 있는 비 마약성 진통제의 유력한 표적으로 인식돼 왔다.
하지만 정확한 선별 능력(on-target selectivity)을 갖춘 분자를 찾아내지 못한데다 부작용 우려도 커 지금까지 진통제로 개발되지 못했다.
모내시대 연구팀은 알로스테릭 효과(allosteric effect) 양성인 PAM(positive allosteric modulator) 조절 인자가 A1 수용체에 훨씬 더 선별적으로 작용한다는 걸 발견했다.
알로스테릭 효과란, 단백질의 원래 기능을 수행하는 활성 자리(active site) 외의 다른 특정 부위에 활성인자가 결합해 활성 자리의 구조가 변하는 걸 말한다.
PAM은 A1 수용체의 다른 부위에 결합해 신경병성 통증을 최소한의 부작용으로 완화할 뿐 아니라 척수의 통증 신호가 강해지는 것에 맞춰 작용 수위를 높였다.
연구팀은 또 진통 작용을 하는 PAM과 아데노신이 모두 결합하는 A1 수용체의 고해상 구조를 극저온 전자현미경(cryoEM)으로 풀어냈다.
비 마약성 진통제가 직접 작용하는 A1 수용체의 고해상 원자 구조가 밝혀진 건 처음이다.
모내시대 생물의학 발견 연구소(BDI)의 '통증 메커니즘 랩(lab)' 팀장인 웬디 임래치(Wendy Imlach) 부교수는 "이번 연구를 통해 알로스테릭 약물의 작용 메커니즘을 더 깊이 이해하게 됐다"라고 말했다.
논문의 공동 교신저자인 크리스토풀로스 교수는 "현재 글로벌 마약 위기를 겪고 있는 만큼 안전하고 효과적인 비 마약성 진통제 개발이 시급하다"라면서 "(이번 연구 결과를 바탕으로) 구조 기반(structure-based)의 통찰을 지렛대로 활용해, 만성 통증을 효과적으로 치료하는 비 마약성 알로스테릭 약물을 디자인할 수 있을 것"이라고 강조했다.







댓글목록