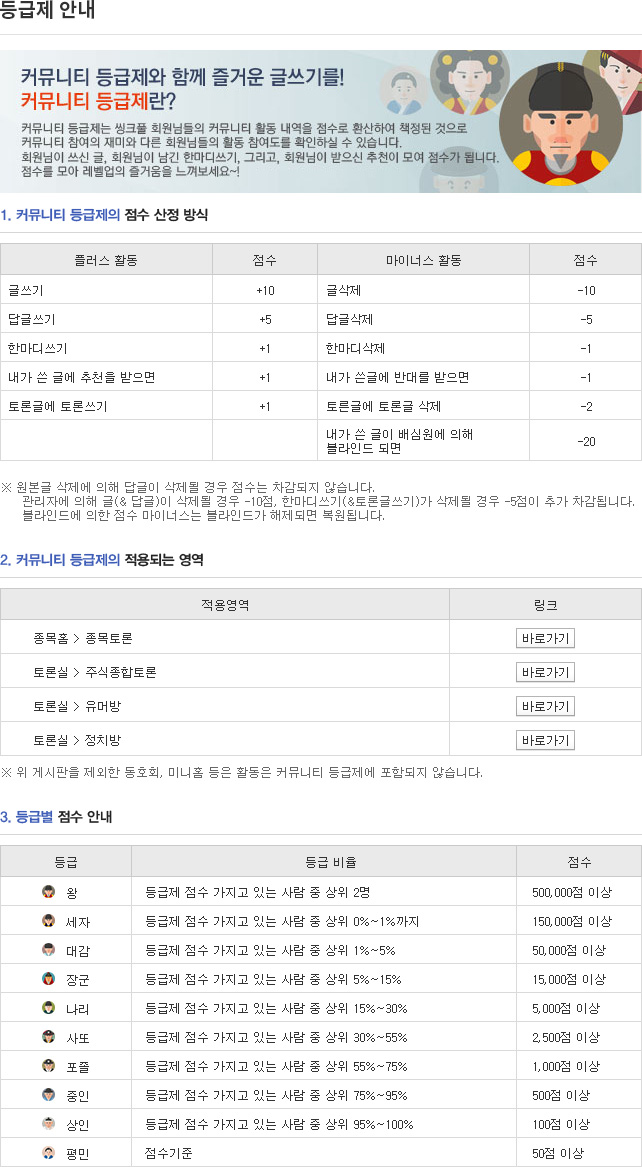
종목토론카테고리
게시판버튼
게시글 제목
FDA 조직도및 지난 주 활동 상황게시글 내용
Drugs, Devices, and Biologics
Learn directly from the FDA’s regulatory experts in medical product centers: drugs, devices, and biologics. This course is designed to provide participants with a strong, basic foundation in the FDA’s regulatory requirements. This conference has been approved for 30.25 continuing education units for pharmacists, physicians, and nurses. Please see detailed announcement for more information.
AGENDA External Link Disclaimer
KEYNOTE SPEAKER
Janet Woodcock M.D.
Acting Commissioner of Food and Drugs
Food and Drug Administration
FDA Voices Article by Dr. Woodcock
PLENARY
This plenary session will reflect on FDA’s use of Emergency Use Authorizations (EUAs) and other resources in making drug, device, and biological products available to support the public health response to the COVID-19 pandemic.
An emergency use authorization, or EUA, is a regulatory pathway that allows FDA to help strengthen the nation’s public health protections by facilitating the availability and use of medical countermeasures needed during public health emergencies. Under this pathway, FDA may allow unapproved medical products or unapproved uses of approved medical products to be used in an emergency to diagnose, treat, or prevent serious or life-threatening diseases or conditions when there are no adequate, approved, and available alternatives.
Patrizia Cavazzoni M.D.
Director
Center for Drug Evaluation and Research (CDER)
Jeff Shuren M.D., J.D.
Director
Center for Devices and Radiological Health (CDRH)
Peter Marks M.D., PhD.
Director
Center for Biologics Evaluation and Research (CBER)
This conference is FREE
DRUGS TRACK
The drugs track External Link Disclaimer will focus on the operations of Center for Drug Evaluation and Research (CDER) offices directly involved in the drug assessment process and their interaction with each other.
Topics
- CDER NextGen Portal
- Communication Best Practices
- Drug Development and Precision Medicine
Audience
- Regulatory affairs and other professionals working on the development and preparation of new drug submissions
- Sponsors, applicant holders, manufacturers and regulatory affairs professionals wishing to gain insight on drug assessment
- Industry professionals at all levels of expertise
DEVICES TRACK
The devices track External Link Disclaimer will focus on evidence quality and data expectations that impact regulatory decisions involving medical devices regulated by the Center for Devices and Radiological Health (CDRH).
- Premarket submissions
- Quality system principles
- Additive manufacturing
Audience
- Industry professionals working on development and preparation of new device submissions
- Manufacturers and regulatory affairs professionals seeking to enhance their knowledge about the FDA Quality System (21 CFR 820) and applicable subsystems
- Device manufacturers and innovators seeking to incorporate additive manufacturing into their device processes and regulatory strategies
BIOLOGICS TRACK
The biologics track External Link Disclaimer will focus on the development of advanced therapies, including cellular and tissue-based products, gene therapies, plasma-derived therapeutics, and devices regulated by Center for Biologics Evaluation and Research (CBER). Different aspects of product development will be discussed (product quality, pharmacology toxicology, and clinical).
Topics
- “Tissue Rule”: Regulation of products under 21 CFR part 1271
- Development and regulation of cellular therapies, gene therapies, and plasma-derived therapeutics
- Expedited development programs for advanced therapies
Audience
- Biotechnology product manufacturers, academic sponsors, and other stakeholders working on the development of advanced therapies
- Regulatory affairs and other professionals working with submissions of INDs and BLAs to the Office of Tissues and Advanced Therapies in the Center for Biologics Evaluation and Research
- Industry and consulting professionals working with advanced therapies, cell-or tissue-based products, and devices used with biological products
CONTINUING EDUCATION
Real-time attendance is required for the certificate of attendance which can be used in support of CEs for the following professional organizations. Certificates are only available during the two weeks post-event.
This course has been:
- approved for 30.25 continuing education units for pharmacists, physicians, and nurses. Please see detailed announcement for more information.
- pre-approved by RAPS as eligible for a maximum of 12 credits for a 2 day event (appropriate to real-time attendance) towards a participant’s RAC recertification upon full completion.
- pre-approved by SOCRA who accepts documentation of candidate participation in continuing education programs for re-certification if the program is applicable to clinical research regulations, operations or management, or to the candidate's clinical research therapeutic area.
- pre-approved by SQA as eligible for 1 non-GCP or non-GLP unit for every 1 hour of instructional time towards a participant’s RQAP re-registration.
- approved by ACRP for continuing education in clinical research. ACRP will provide 1 ACRP contact hour for every 45-60 minutes of qualified material.
TECHNICAL INFORMATION AND QUESTIONS
- To optimize your webinar experience, use Chrome when viewing AdobeConnect in a browser.
- Please contact info@sbiaevents.comfor all technical questions.
- If you encounter any technical issues before or during the event, please visit the Technical Issues Support External Link Disclaimer.
- Test your PC for use with Adobe Connect External Link Disclaimer prior to the day of the event. Adobe, the Adobe logo, Acrobat and Acrobat Connect are either registered trademarks or trademarks of Adobe Systems Incorporated in the United States and/or other countries.
FDA RESOURCES
Drugs
- CDER SBIA Learn: Webinars, Conferences, Trainings
- CDERLearn Training and Education
- Development & Approval Process
Devices
- Device Advice: Comprehensive Regulatory Assistance
- CDRH Learn
- Division of Industry and Consumer Education External Link Disclaimer
Biologics
- OTAT Learn
- Manufacturers Assistance and Technical Training Branch website
- Testing Human Cells, Tissues, and Cellular and Tissue Based Product (HCT/P) Donors for Relevant Communicable Disease Agents and Diseases
- 약물, 장치 및 생물학
의약품 센터의 FDA 규제 전문가(약, 장치 및 생물)로부터 직접 배울 수 있습니다. 이 과정은 참가자들에게 FDA의 규제 요건에 대한 견고하고 기본적인 기반을 제공하기 위해 고안되었습니다. 본 컨퍼런스는 약사, 의사 및 간호사를 위한 30.25개의 지속 교육 단위로 승인되었습니다. 자세한 내용은 자세한 안내방송을 참조하십시오.
의제→외부 링크 고지 사항
자넷 우드콕
기조 연설자
자넷 우드콕 M.D.
식품의약품안전청장 권한대행
미국 식품의약국
Dr.의 FDA Voice 기사 우드콕
전체
본 총회에서는 FDA가 의약품, 장치 및 생물학적 제품을 만드는 데 사용하는 비상 사용 허가(EUA)와 기타 자원을 통해 COVID-19 대유행의 공공 보건 대응을 지원할 수 있도록 하는 내용을 반영합니다.
비상사용허가(EUA)는 FDA가 공중보건 비상시 필요한 의료대책을 쉽게 이용할 수 있도록 함으로써 국가의 공중보건 보호를 강화할 수 있도록 하는 규제 경로이다. 이 경로에 따라 FDA는 승인되지 않은 의약품 또는 승인되지 않은 의약품의 사용을 적절한, 승인되고 사용 가능한 대안이 없을 때 심각하거나 생명을 위협하는 질병이나 상태를 진단, 치료 또는 예방하기 위해 비상시에 사용하도록 허용할 수 있다.
파트리지아 카바조니
패트리샤 카바조니 M.D.
감독
의약품 평가 및 연구 센터(CDER)
제프 슈렌
제프 슈렌 M.D., J.D.
감독
장치 및 방사선 건강 센터(CDRH)
피터 마크스
피터 마크스 박사입니다
감독
바이오로지스 평가 및 연구 센터(CBER)
이 컨퍼런스는 무료입니다.
마약 추적
마약자국 ♡외부 링크 면책 조항은 약물 평가 및 연구 센터(CDER) 사무소의 운영과 약물 평가 프로세스 및 상호 작용에 중점을 둡니다.
주제
•CDER 차세대 포털
• 커뮤니케이션 모범 사례
•의약품 개발 및 정밀의학
관객
• 신약 제출의 개발 및 준비에 대한 규제 업무 및 기타 전문가
• 의약품 평가에 대한 통찰력을 얻고자 하는 후원자, 신청자, 제조업체 및 규제 전문가
•모든 수준의 전문성을 갖춘 업계 전문가
장치 추적
장치 추적 ▲외부 링크 거부권은 CDRH(Center for Devices and Radiological Health)가 규제하는 의료기기 관련 규제 결정에 영향을 미치는 증거 품질과 데이터 기대에 초점을 맞출 것입니다.
• 사전 시장 제출
• 품질 시스템 원칙
•첨가제 제조
관객
• 새로운 장치 제출의 개발 및 준비에 종사하는 산업 전문가
• FDA 품질 시스템(21 CFR 820) 및 적용 가능한 하위 시스템에 대한 지식을 향상시키려는 제조업체 및 규제 전문가
• 장치 프로세스 및 규제 전략에 적층 제조를 통합하고자 하는 장치 제조업체 및 혁신업체
바이오로지스 트랙
바이오로지 트랙 ▲외부 링크 거부권은 세포 및 조직 기반 제품, 유전자 치료제, 혈장 유래 치료제, CBER(Center for Biologics Evaluation and Research)가 규제하는 장치 등 첨단 치료법 개발에 초점을 맞춘다. 제품 개발의 다양한 측면(제품 품질, 약리 독성학, 임상)이 논의됩니다.
주제
• "조직 규칙": 21 CFR 파트 1271에 따른 제품 규정
•세포 치료제, 유전자 치료제, 혈장 유도 치료제의 개발 및 규제
•고급 요법을 위한 개발 프로그램 가속화
관객
• 생명공학 제품 제조업체, 학술 후원자 및 기타 이해당사자들이 첨단 치료법 개발에 힘쓰고 있음
• 규제 업무 및 기타 BLA를 생물학 평가 및 연구 센터의 조직 및 고급 치료 사무소에 제출하는 전문가
• 첨단 치료법, 세포 또는 조직 기반 제품 및 생물학적 제품과 함께 사용되는 장치를 다루는 산업 및 컨설팅 전문가
지속적인 교육
다음 전문 기관의 CE 지원에 사용할 수 있는 출석 증명서는 실시간 출석이 필요합니다. 인증서는 이벤트 후 2주 동안만 사용할 수 있습니다.
본 과정은 다음과 같습니다.
• 약사, 의사 및 간호사를 위한 30.25 지속 교육 단위에 대해 승인됨. 자세한 내용은 자세한 안내방송을 참조하십시오.
• 참가자의 RAC 재인증이 완료되는 즉시 2일 동안(실시간 참석에 적합) 최대 12학점을 받을 수 있도록 RAP에 의해 사전 승인됨
게시글 찬성/반대
- 2추천
- 1반대
운영배심원의견
운영배심원의견이란
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.










댓글목록