종목토론카테고리
게시판버튼
게시글 제목
FDA 국장 코로나 19 대응 청문회 제출 자료게시글 내용
| 07/20/2021 | Today, Acting FDA Commissioner Janet Woodcock, M.D. testified before the U.S. Senate Committee on Health, Education, Labor and Pensions in a hearing titled, The Path Forward: A Federal Perspective on the COVID-19 Response. |
COVID-19 Update | Biologics Medical Devices |
| 07/20/2021 | The Path Forward: A Federal Perspective on the COVID-19 Response Hearing before the U.S. Senate Committee on Health, Education, Labor and Pensions; Acting Commissioner Janet Woodcock, M.D. testifies for the FDA. Read written testimony. |
Event | Biologics Drugs Food & Beverages Medical Devices |
07/20/2021
코로나 바이러스(COVID-19) 업데이트
오늘 자넷 우드콕 미 식품의약국(FDA) 집행위원 권한대행은 미 상원 보건 교육 노동 연금 위원회(Committee for Health, Education, Labor and Pensions)에서 '전진 경로: A Federal Perspections on the COVID-19 Response'라는 제목의 청문회에서 증언했습니다.
COVID-19 업데이트 바이오로지스
의료 기기
07/20/2021
향후 경로: COVID-19 대응에 대한 연방 정부의 관점
미 상원 보건 교육 노동 연금 위원회 청문회에서 자넷 우드콕 M.D. 집행위원 권한대행은 FDA에 대한 서면 증언을 읽습니다.
이벤트 바이오로지스
마약
식음료
의료 기기
Introduction
Chair Murray, Ranking Member Burr, distinguished members of the Committee, I am Dr. Janet Woodcock, Acting Commissioner of the U.S. Food and Drug Administration (FDA or the Agency). Thank you for the opportunity to testify before you today to describe FDA’s coronavirus disease 2019 (COVID-19) response efforts. All of our efforts are in close coordination and collaboration with our partners, both within the Department of Health and Human Services (HHS) and across the Federal government, to help ensure the development, authorization, licensure, and availability of critical, safe, and effective medical products to address the COVID-19 public health emergency.
I want to note at the outset that this is just a snapshot of some of our recent work and is in the context of efforts across the Agency to address this pandemic. There are thousands of FDA employees who have been working non-stop for the past year-and-a-half. I want to commend and recognize their efforts and thank them for their service.
From the beginning of this public health emergency, FDA has taken an active leadership role in the all-of-government response to the COVID-19 pandemic, inspired by the resiliency of the American people and our great innovators. FDA stood up an internal cross-agency group that continues to ensure we are doing everything possible to protect the American public, help ensure the safety, efficacy, and quality of FDA-regulated medical products, and provide the industries we regulate with the guidance and tools to do the same. We continue to focus on facilitating the development and availability of medical countermeasures to diagnose, treat, and prevent COVID-19, surveilling the medical product and food supply chains for potential shortages or disruptions, and helping to mitigate such impacts, as necessary to protect the public health.
Biologics and Vaccines
FDA’s Center for Biologics Evaluation and Research (CBER) uses every tool available to help patients access promising biological products while facilitating research to evaluate their safety and efficacy as well as manufacturing efforts.
CBER is working on multiple fronts to address the COVID-19 pandemic, including:
- Expediting clinical trials for vaccines and certain therapeutic biological products that hold promise to prevent or treat COVID-19 by providing timely interactions, scientific advice, and recommendations for specific sponsors, and generally through guidance documents;
- Supporting product development and facilitating the scaling up of manufacturing capacity for high priority products to treat COVID-19;
- Expediting the review of Emergency Use Authorization (EUA) requests and Biologics License Applications (BLAs) for critical medical products to address COVID-19;
- Helping to ensure an adequate and safe blood supply; and
- Providing information to healthcare providers and researchers to help them submit expanded access IND requests to permit the use of investigational products for patients with COVID-19.
Through our transparent scientific review process, FDA has issued EUAs for three COVID-19 vaccines. In doing so, we have relied upon the Agency’s rigorous standards for safety, effectiveness, and manufacturing quality. Development of a vaccine generally proceeds sequentially through the various stages of clinical development; ordinarily this process minimizes scientific and financial risk for the manufacturer. Manufacturing scale-up only takes place when the data support the safety and effectiveness of a vaccine and it is on track for regulatory approval. These three COVID-19 vaccines were developed without cutting corners or sacrificing our standards. Intensive interactions between FDA and manufacturers minimized the time between different studies in the clinical development process; allowed seamless movement throughout the different phases of clinical trials; and simultaneously facilitated manufacturers proceeding with manufacturing scale-up before it was clear whether the safety and effectiveness data for a vaccine would support EUA.
For the three vaccines authorized to date, our EUA process not only included a thorough evaluation of the data by the Agency’s career staff, but also included input from independent scientific and public health experts through our public advisory committee meetings. Throughout this process, FDA took additional steps to facilitate transparency, such as posting sponsor and FDA briefing documents and key decisional memoranda.
The three authorizations make available COVID-19 vaccines in the United States that have shown clear and compelling efficacy in large, well-designed phase 3 trials. These vaccines have met rigorous standards for safety and effectiveness to support EUA and are helping us in the fight against this pandemic. All the COVID-19 vaccines that FDA has authorized for emergency use are at least 50 percent effective compared to placebo in preventing COVID-19, which is the expectation we conveyed in our June 2020 guidance document, Development and Licensure of Vaccines to Prevent COVID-19.1 A vaccine with at least 50 percent efficacy, we noted, would have a significant impact on disease, both at the individual and societal level.
소개
머레이 의장, 버, 위원회의 저명한 위원들, 저는 미국 식품의약국(FDA)의 권한대행인 자넷 우드콕 박사입니다. 오늘 앞에서 FDA의 2019년 코로나바이러스 질병(COVID-19) 대응 노력에 대해 증언할 기회를 주셔서 감사합니다. NAT의 모든 노력은 보건 및 휴먼 서비스부(HHS) 내 및 연방 정부 전반에 걸쳐 파트너와 긴밀히 협력하고 있으며, 이를 통해 중요하고 안전하며 효과적인 의료 제품의 개발, 허가 및 가용성을 보장함으로써 COVID-19 공중 보건 문제를 해결할 수 있습니다.엔시.
나는 처음에 이것이 단지 우리의 최근 작업의 스냅숏일 뿐이며 이 대유행을 해결하기 위한 기관의 노력의 맥락이라는 것을 주목하고 싶다. 지난 1년 반 동안 쉬지 않고 일해 온 수천 명의 FDA 직원들이 있다. 나는 그들의 노력을 칭찬하고 인정하며 그들의 봉사에 감사를 표하고 싶습니다.
공중 보건 비상사태가 시작된 이래, FDA는 미국 국민들과 우리의 위대한 혁신가들의 회복력에 영감을 받아, COVID-19 대유행의 정부 차원의 대응에 적극적인 리더십 역할을 수행해 왔습니다. FDA는 우리가 미국 대중을 보호하고, FDA가 규제하는 의약품의 안전, 효능 및 품질을 보장하고, 규제하는 산업에 동일한 작업을 수행할 수 있는 지침과 도구를 제공하기 위해 가능한 모든 것을 수행하고 있음을 지속적으로 확인하는 내부 기관 간 그룹을 설립했습니다. 우리는 공공보건을 보호하기 위해 필요한 경우, COVID-19를 진단, 치료 및 예방하기 위한 의료대책의 개발 및 가용성을 촉진하고, 의약품 및 식품 공급망에서 잠재적 부족이나 차질을 조사하고, 그러한 영향을 완화하는 데 지속적으로 초점을 맞추고 있습니다.
바이오로지스 및 백신
FDA의 CBER(Center for Biologics Evaluation and Research)는 환자들이 유망한 생물학적 제품에 접근할 수 있도록 지원하는 모든 도구를 사용하는 동시에 제조 노력뿐만 아니라 안전성 및 효능을 평가하는 연구를 용이하게 합니다.
CBER는 다음을 포함한 다양한 전선에서 COVID-19 대유행 문제를 해결하기 위해 노력하고 있습니다.
•특정 후원자에게 시기적절하게 상호작용, 과학적 조언 및 권고사항을 제공하고 일반적으로 지침 문서를 통해 COVID-19 예방 또는 치료 가능성을 가진 백신 및 특정 치료용 생물학적 제품에 대한 임상시험의 신속화
• 제품 개발 지원 및 우선 순위가 높은 제품의 제조 용량 확장 촉진, COVID-19 치료
•COVID-19를 다루기 위한 중요 의약품에 대한 긴급사용허가(EUA) 요청 및 BLA(Biologics License Applications) 검토 가속화
• 적절하고 안전한 혈액 공급 보장
•의료 제공자와 연구자가 COVID-19 환자에 대한 조사 제품 사용을 허용하기 위해 확장된 액세스 IND 요청을 제출할 수 있도록 정보를 제공합니다.
FDA는 우리의 투명한 과학적 검토 과정을 통해 3개의 COVID-19 백신에 대한 EUA를 발행했습니다. 이를 위해 우리는 안전, 효과 및 제조 품질에 대한 기관의 엄격한 기준에 의존해 왔습니다. 백신 개발은 일반적으로 임상 개발의 다양한 단계를 통해 순차적으로 진행되며, 일반적으로 이 과정은 제조 업체의 과학적, 재정적 위험을 최소화합니다. 제조 스케일업은 데이터가 백신의 안전성과 효과를 뒷받침하고 규제 승인을 위한 궤도에 오를 때에만 이루어집니다. 이 세 가지 COVID-19 백신은 지름길이나 우리의 표준을 희생하지 않고 개발되었습니다. FDA와 제조업체 간의 집중적인 상호 작용으로 임상 개발 프로세스에서 서로 다른 연구 간의 시간을 최소화하고, 임상 시험의 여러 단계 전반에 걸쳐 원활한 이동을 가능하게 했으며, 제조업체들이 안전성과 효과성이 명확해지기 전에 제조 스케일업을 진행하도록 촉진했습니다.백신에 대한 eness 데이터는 EUA를 지원할 것이다.
현재까지 승인된 3가지 백신에 대해 EUA 과정은 기관 경력직원의 철저한 데이터 평가뿐만 아니라 공보위원회 회의를 통한 독립적인 과학 및 공중 보건 전문가의 의견도 포함했습니다. 이 과정에서 FDA는 스폰서와 FDA 브리핑 문서, 주요 결정 메모 등을 게시하는 등 투명성을 높이기 위한 추가 조치를 취했다.
이 세 가지 인증은 잘 설계된 대규모 3단계 임상시험에서 명확하고 설득력 있는 효능을 보여준 미국에서 사용 가능한 COVID-19 백신을 만든다. 이 백신들은 EUA를 지원하기 위한 안전과 효율에 대한 엄격한 기준을 충족시켰고 이 전염병에 맞서 싸우는 데 도움을 주고 있다.
As part of our continued efforts to be transparent and educate the public, we have a wealth of information on our website about the authorized COVID-19 vaccines. The information includes fact sheets for healthcare providers (vaccination providers) and vaccine recipients and caregivers, with important information such as dosing instructions; information about the benefits and risks of each authorized vaccine; and topical Questions and Answers developed by FDA for each authorized vaccine.2
It is also important to highlight that, as part of each EUA, we are requiring the manufacturers and vaccination providers to report serious adverse events, cases of Multisystem Inflammatory Syndrome (MIS), and cases of COVID-19 that result in hospitalization or death to the Vaccine Adverse Event Reporting System (VAERS), a national vaccine safety surveillance program jointly run by FDA and the Centers for Disease Control and Prevention (CDC).
These surveillance efforts have led the Agency to take steps to proactively address emerging safety signals. In April, out of an abundance of caution, FDA and CDC recommended a pause in the use of the Janssen COVID-19 vaccine while we investigated reports of thrombosis with thrombocytopenia syndrome. Later that month, after careful evaluation of the data, FDA announced revisions to the vaccine recipient fact sheet to include information about the risk of thrombosis with thrombocytopenia, and the vaccination provider fact sheet to include a warning about the risk of thrombosis with thrombocytopenia syndrome. We concluded that the available data suggest that the chance of this serious adverse event occurring is very low. FDA and CDC determined that the recommended pause regarding the use of the Janssen COVID-19 vaccine in the U.S. should be lifted and use of the vaccine should resume. As with all of the COVID-19 vaccines, we continue to closely monitor the safety of the Janssen COVID-19 Vaccine.
On June 25, FDA announced revisions to the vaccine recipient and caregivers and vaccination provider fact sheets for the Moderna and Pfizer-BioNTech COVID-19 vaccines regarding the suggested increased risks of myocarditis and pericarditis following vaccination. The chance of these adverse events occurring following administration of either the Moderna or Pfizer-BioNTech COVID-19 vaccine appears to be very low, but the level of potential risk due to vaccination is still under investigation. FDA and CDC are monitoring the reports, collecting more information, and will follow up to assess longer-term outcomes over several months.
On July 12, FDA announced revisions to the vaccine recipient and caregivers and vaccination providers fact sheets for the Janssen COVID-19 vaccine regarding a suggested increased risk of Guillain-Barré syndrome during the 42 days following vaccination. The chance of this occurring following vaccination appears to be very low.
At this time, data are not yet available to make a determination about how long these authorized vaccines will provide protection, nor are we certain that the vaccines prevent transmission of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) from person to person. Additionally, although we do not yet know the full range of SARS-CoV-2 variants that each of the authorized vaccines will protect against, there is evidence that the current vaccines protect against disease caused by variants circulating in the United States.
Finally, manufacturers whose COVID-19 vaccines have been authorized for emergency use are expected to continue their clinical trials in order to obtain additional safety and effectiveness information and pursue licensure (approval).
투명하고 대중을 교육하기 위한 지속적인 노력의 일환으로, 당사 웹사이트에는 공인된 COVID-19 백신에 대한 풍부한 정보가 있습니다. 이 정보에는 투여 지침, 각 승인된 백신의 유익성과 위해성에 대한 정보, 각 승인된 백신에 대해 FDA가 개발한 주제별 질문과 답변과 같은 중요한 정보가 포함된 의료 제공자(백신 제공자)와 백신 수급자 및 보호자를 위한 팩트 시트가 포함되어 있다.2
또한 각 EUA의 일부로서 제조사와 백신 공급자에게 국가 백신 안전 보고 시스템인 백신 부작용 보고 시스템(VARS)에 심각한 부작용, MIS(Multisystem Infraitory Syndrome) 사례 및 입원 또는 사망에 이르는 COVID-19 사례를 보고하도록 요구하는 것도 중요합니다.FDA와 질병통제예방센터(CDC)가 공동으로 운영하는 감시 프로그램.
이러한 보안 감시 노력 덕분에 기관은 새롭게 부상하는 안전 신호를 능동적으로 다루기 위한 조치를 취하게 되었습니다. 지난 4월, 많은 주의를 기울여 FDA와 CDC는 혈전증 증후군이 있는 혈전증 보고서를 조사하는 동안 얀센 COVID-19 백신 사용을 중단하라고 권고했습니다. FDA는 지난달 말 면밀한 데이터 검토 끝에 혈전증 위험 정보를 백신 수령자 자료표와 혈전증 증후군 위험 경고를 포함하도록 백신 제공자 자료표의 개정을 발표했다. 우리는 이용 가능한 데이터를 통해 이러한 심각한 부작용 발생 가능성이 매우 낮다는 결론을 내렸다. FDA와 CDC는 미국 내 얀센 COVID-19 백신 사용에 대한 권고 중단 조치를 해제하고 백신 사용을 재개해야 한다고 판단했다. 모든 COVID-19 백신과 마찬가지로, 우리는 얀센 COVID-19 백신의 안전성을 면밀히 감시하고 있습니다.
6월 25일, FDA는 현대나와 화이자 바이오에 대한 백신 수급자, 보호자 및 예방접종 제공자 현황표에 대한 개정안을 발표했다.예방접종 후 제안된 심근염 및 심막염 위험 증가와 관련된 NTech COVID-19 백신. Moderna 또는 Pfizer-Bio 투여 후 이러한 부작용 발생 가능성NTech COVID-19 백신은 매우 낮은 것으로 보이지만, 예방접종으로 인한 잠재적 위험 수준은 아직 조사 중에 있다. FDA와 CDC는 보고서를 모니터링하며 더 많은 정보를 수집하고 있으며, 몇 개월 동안 장기적인 결과를 평가하기 위해 후속 조치를 취할 예정입니다.
7월 12일, FDA는 백신 접종 후 42일 동안 길랭-바레 증후군의 위험 증가와 관련하여 얀센 바이러스-19 백신에 대한 백신 수령자와 보호자 및 백신 제공자 현황표의 개정을 발표했다. 예방접종 후 이런 일이 발생할 가능성은 매우 낮은 것으로 보인다.
현재 이들 공인 백신이 언제까지 보호를 제공할 것인지에 대한 자료는 아직 확보되지 않았으며, 이 백신이 중증급성호흡기증후군 코로나바이러스2(SARS-CoV-2)의 사람 간 전염을 막을지도 확실치 않다. 게다가, 우리는 각 공인 백신들이 보호하게 될 SARS-CoV-2 변종들의 전 범위를 아직 알지는 못하지만, 현재 백신이 미국에서 유통되는 변종들에 의해 야기되는 질병으로부터 보호해준다는 증거가 있다.
마지막으로, 추가적인 안전 및 효과 정보를 획득하고 인허가(승인)를 추구하기 위해 긴급 사용이 허가된 제조사는 임상시험을 계속할 것으로 예상된다.
Having three vaccines authorized to date that meet FDA’s expectations for safety and effectiveness only one year after the declaration of the COVID-19 pandemic is a tremendous achievement and a testament to the dedication of developers and FDA’s career scientists and physicians. We are highly engaged in ensuring that all COVID-19 vaccines meet the high quality that Americans expect and deserve and are also actively engaged in ensuring the safety of these vaccines following deployment. FDA is also working with international partners as part of multinational efforts to end this global pandemic. We have provided guidance and technical assistance, and continue to share information as we evaluate and release vaccine doses for use in other countries. The Agency is very proud of these efforts, and we believe that the vaccines will help bring this pandemic to an end.
Therapeutics
Since the beginning of the COVID-19 pandemic, FDA has been working tirelessly to facilitate the development and availability of therapeutics for use by patients, physicians, and health systems as expeditiously and safely as possible. FDA has also accelerated the development and publication of guidance and other information for industry and researchers on developing COVID-19-related treatments. Further, on March 31, 2020, FDA announced the creation of an emergency review and development program for possible therapies for COVID-19, the Coronavirus Treatment Acceleration Program, or “CTAP.” The primary goal of CTAP is to help accelerate the development of therapeutics for patients and consumers. The Agency has supported the program by reassigning staff and working continuously to review requests from companies, scientists, and doctors who are working to develop therapies. Under CTAP, FDA is using every available authority and regulatory flexibility to facilitate the development of safe and effective products to treat patients with COVID-19. As of June 30, 2021, there are more than 630 drug development programs in planning stages and the Agency has reviewed more than 460 trials of potential therapies for COVID-19. These include antivirals, immunodulators, neutralizing antibodies, cell and gene therapies, and combinations of these products. The diversity of therapeutic approaches being investigated is important because it rapidly expands our understanding of the effect of different categories of potential treatments.
FDA has approved one drug to treat COVID-19 and eleven therapeutics are currently authorized for emergency use. Our goal is to be as transparent as possible about the scientific basis for recommending that a drug or biological product be authorized for emergency use under section 564 of the Federal Food, Drug and Cosmetic Act (21 U.S.C. 360bbb-3) or for recommending that an EUA be revised or revoked.
FDA also continues to work closely with manufacturers to mitigate and prevent shortages as
the COVID-19 pandemic evolves. For example, the Agency has issued three EUAs to authorize the emergency use of certain therapeutic products intended to treat serious or life-threatening diseases or conditions (e.g., Acute Kidney Injury, Acute Respiratory Distress Syndrome) caused by COVID-19 after determining that the FDA-approved alternatives to these products were not available in sufficient quantities to fully meet the emergency need. This has helped to alleviate shortages of some therapies that are essential for the care of critically ill COVID-19 patients. FDA is also working with manufacturers to increase supplies to meet current demand by expediting review of applications. In addition, the Agency has prioritized the review of generic drug applications for potential treatments and supportive therapies for patients with COVID-19, such as antibiotics, sedatives used in ventilated patients, anticoagulants, and pulmonary medications. In June 2021, FDA reached a milestone of approving 1,000 original and supplemental generic drug applications since the start of the pandemic to help in the treatment of patients with COVID-19. This supports FDA’s everyday mission of improving access to safe, effective, high-quality treatment options, especially during the COVID-19 pandemic.
COVID-19 대유행 선포 후 1년 만에 안전성과 효과에 대한 FDA의 기대를 충족시키는 백신 3종을 지금까지 허가받은 것은 엄청난 성과이며, 개발자와 FDA의 직업 과학자와 의사들의 헌신을 증명하는 증거이다. 우리는 모든 COVID-19 백신이 미국인들이 기대하며 마땅히 받아야 할 높은 품질에 부합할 수 있도록 하는 데 크게 관여하고 있으며, 배치 후 이러한 백신의 안전성을 보장하는 데도 적극적으로 참여하고 있습니다. FDA는 또한 이러한 세계적 대유행을 종식시키기 위한 다국적 노력의 일환으로 국제적인 파트너들과 협력하고 있다. 우리는 지침과 기술 지원을 제공했으며, 다른 나라에서 사용할 백신 선량을 평가하고 출시하면서 정보를 지속적으로 공유했다. 이 기관은 이러한 노력에 대해 매우 자랑스러워하며, 우리는 이 백신들이 이 전염병을 종식시키는 데 도움이 될 것이라고 믿는다.
치료학
COVID-19 대유행의 시작 이후 FDA는 환자, 의사 및 보건 시스템이 최대한 신속하고 안전하게 사용할 수 있는 치료제의 개발과 가용성을 촉진하기 위해 지칠 줄 모르는 노력을 기울이고 있습니다. FDA는 또한 COVID-19 관련 치료제 개발에 대한 업계 및 연구자들을 위한 지침 및 기타 정보의 개발 및 게시를 가속화했습니다. 또한, 2020년 3월 31일, FDA는 가능한 COVID-19 치료제인 Coronarius Treatment Acceleration Program, 즉 "CTAP"에 대한 긴급 검토 및 개발 프로그램을 만들 것이라고 발표했다. CTAP의 주요 목표는 환자와 소비자를 위한 치료제 개발을 가속화하는 것입니다. 이 기관은 직원을 재배치하고 치료법을 개발하기 위해 일하는 회사, 과학자, 의사들의 요청을 검토하기 위해 지속적으로 일함으로써 이 프로그램을 지원해왔다. CTAP에 따르면 FDA는 모든 사용 가능한 권한과 규제 유연성을 활용하여 안전하고 효과적인 제품 개발을 촉진하고 있습니다. 2021년 6월 30일 현재 630개 이상의 의약품 개발 프로그램이 계획 단계에 있으며, 기관은 460개 이상의 잠재적 치료제인 COVID-19 임상시험을 검토했다. 여기에는 항바이러스제, 면역조절제, 중화 항체, 세포 및 유전자 치료제, 이 제품들의 조합이 포함됩니다. 조사 중인 치료 접근법의 다양성은 잠재적 치료의 다른 범주의 효과에 대한 우리의 이해를 빠르게 확장시키기 때문에 중요하다.
FDA는 현재 1개 의약품의 COVID-19 치료제를 승인했으며 11개 치료제는 긴급 사용이 허가됐다. 우리의 목표는 연방식품, 의약품 및 화장품법 제564조(21 U.S.C. 360bb-3)에 따라 긴급 사용을 권장하거나 EUA의 개정 또는 취소를 권고하는 과학적 근거에 대해 가능한 한 투명하게 하는 것이다.
FDA는 또한 다음과 같이 부족을 완화하고 예방하기 위해 제조업체와 긴밀히 협력하고 있습니다.
COVID-19 대유행은 진화한다. 예를 들어, 기관은 이러한 제품에 대한 FDA 승인 대안이 효용되지 않는다고 판단한 후, COVID-19에 의해 야기된 심각하거나 생명을 위협하는 질병이나 질환(예: 급성 신장 부상, 급성 호흡곤란 증후군)을 치료하기 위한 특정 치료 제품의 긴급 사용을 허가하기 위해 3개의 EUA를 발행했다.충분한 양으로 블링블링해야 비상 요구를 충분히 충족할 수 있습니다. 이는 중증 환자들을 돌보는 데 필수적인 몇몇 치료법의 부족을 줄이는 데 도움을 주었다. FDA도 신속한 적용 검토를 통해 공급량을 늘리기 위해 제조사와 협력하고 있다. 또한, 해당 기관은 항생제, 인공호흡 환자, 항응고제, 폐의약품 등 COVID-19 환자에 대한 잠재적 치료 및 지원 요법에 대한 일반 의약품 적용 검토에 우선순위를 두고 있다. 2021년 6월, FDA는 전염병이 시작된 이래 1,000건의 오리지널 및 보조 일반 의약품 신청을 승인하여 COVID-19 환자 치료에 도움을 주는 이정표를 세웠다. 이는 특히 COVID-19 전염병 동안 안전하고 효과적이며 고품질 치료 옵션에 대한 액세스를 개선해야 하는 FDA의 일상적인 임무를 지원합니다.
Medical Devices
The need for medical devices to respond to the COVID-19 pandemic has far exceeded what we experienced in any prior Public Health Emergency (PHE). The first EUAs issued for the COVID-19 PHE were for medical devices, and the volume of EUA requests quickly surpassed (by two orders of magnitude) that of any prior PHE or other situation. Further, the emergency use requests included submissions for devices that CDRH had never received EUA requests for during prior PHEs. This included ventilators and novel devices such as continuous renal replacement therapy devices. Since the start of the pandemic, FDA has issued EUAs or granted full marketing authorization to almost 1,500 medical devices for COVID-19-related uses. In addition, FDA rigorously monitored safety signals and medical device reports using the information to publish 21 letters to healthcare providers and seven safety communications, and FDA completed other pivotal work activities such as addressing supply chain shortages and counterfeit products related to COVID-19.
Diagnostic tests are the first line of defense in an outbreak, and FDA plays an important role to ensure they work through EUA review. The EUA pathway expedites access to accurate diagnostic tests during emergencies, when information gaps and false results may adversely affect individual patient care and public health decision making. EUAs enable molecular diagnostic tests to be developed, validated, authorized, and deployed within weeks rather than several months to over a year, as is typical for test development and traditional premarket submissions. The Agency has employed its EUA authorities to facilitate availability of tests in each PHE or threat situation since 2009, when the Secretary of HHS declared that circumstances exist justifying the authorization of emergency use of in vitro diagnostics. In PHEs, FDA is generally open to receiving and reviewing EUA request for tests from any developer, including commercial kit manufacturers and laboratories.
FDA sought to facilitate COVID-19 test evaluation and authorization through the development and availability of templates. The templates provide recommendations for test validation and a fill-in-the-blank form to streamline the paperwork and make it easier for developers to provide information in support of a request for emergency use authorization. Since providing the first template in January 2020, FDA has been in daily contact with test developers to answer questions and help them through the EUA process. This has proved to be a helpful tool for many. FDA has now made nine templates available for a variety of test types. As of July 13, 2021, these nine templates have received 510,725 hits from those visiting FDA’s website. FDA also supported test developers through establishment of a dedicated mailbox, 24-7 toll-free hotline that ran until July 2020, the posting of over 100 frequently asked questions on our website, and by hosting weekly virtual town halls for test developers. The Agency has worked with over 1,000 test developers since January 2020.
의료 기기
COVID-19 대유행에 대응하기 위한 의료 기기의 필요성은 이전의 공중 보건 비상(PHE)에서 경험했던 것보다 훨씬 뛰어납니다. COVID-19 PHE에 대해 처음 발행된 EUA는 의료기기용이었으며 EUA 요청량은 이전 PHE나 다른 상황에 비해 빠르게 (규모가 2배) 초과했다. 또한, 긴급 사용 요청에는 CDRH가 이전 PHE 동안 EUA 요청을 받은 적이 없는 장치에 대한 제출이 포함되었습니다. 여기에는 인공호흡기와 지속적인 신장 대체 치료기기와 같은 새로운 장치가 포함되었습니다. 전염병이 시작된 이후 FDA는 COVID-19 관련 사용을 위해 약 1,500개의 의료기기에 대해 EUA를 발행하거나 완전한 마케팅 허가를 허가했다. 또한, FDA는 이 정보를 활용하여 의료 제공자에게 21건의 서신을 발행하고 7건의 안전 커뮤니케이션에 대한 안전 신호와 의료기기 보고서를 엄격하게 모니터링하였으며, FDA는 공급망 부족 및 COVID-19 관련 위조 제품 문제 해결 등 기타 중추적인 업무 활동을 완료하였다.
진단 검사는 발병의 첫 방어선이며, FDA는 EUA 검토를 통해 효과가 있는지 확인하는 데 중요한 역할을 합니다. EUA 경로는 정보 격차와 잘못된 결과가 개별 환자 진료 및 공중 보건 의사결정에 악영향을 미칠 수 있는 응급 상황에서 정확한 진단 테스트에 신속하게 접근할 수 있도록 한다. EUA를 사용하면 몇 개월에서 1년 이상이 아닌 몇 주 내에 분자 진단 테스트를 개발, 검증, 승인 및 배치할 수 있습니다. 이는 일반적으로 테스트 개발 및 전통적인 사전 시장 제출에 사용됩니다. AEA는 2009년 이후 HHS 장관이 체외 진단의 긴급 사용 승인을 정당화하는 상황이 존재한다고 선언한 이후 각 PHE 또는 위협 상황에서 테스트의 가용성을 촉진하기 위해 EUA 당국을 고용해 왔다. FDA는 일반적으로 상용 키트 제조업체와 실험실을 포함한 모든 개발자에게서 EUA 테스트 요청을 받고 검토할 수 있습니다.
FDA는 템플릿 개발과 가용성을 통해 COVID-19 검사 평가 및 인가를 촉진하고자 했습니다. 이 템플릿은 테스트 검증에 대한 권장 사항과 빈칸 작성 양식을 제공하여 서류 작업을 간소화하고 개발자가 비상 사용 허가 요청을 지원하는 정보를 보다 쉽게 제공할 수 있도록 합니다. FDA는 2020년 1월 첫 템플릿을 제공한 이후 매일 테스트 개발자와 접촉해 질문에 답하고 EUA 과정을 통해 도움을 주고 있다. 이것은 많은 사람들에게 도움이 되는 도구임이 입증되었습니다. FDA는 현재 다양한 테스트 유형에 대해 9개의 템플릿을 사용할 수 있도록 만들었습니다. 2021년 7월 13일 현재, 이 9개의 템플릿은 FDA 웹사이트를 방문한 사람들로부터 51만 725회의 조회수를 받았습니다. FDA는 또한 2020년 7월까지 운영된 전용 사서함 구축, 24-7 무료 핫라인 구축, 100여 개의 자주 묻는 질문 게시, 테스트 개발자를 위한 주간 가상 타운홀 유치 등을 통해 테스트 개발자를 지원했습니다. 이 기관은 2020년 1월부터 1,000명 이상의 테스트 개발자와 협력해왔다.
Since early 2020, FDA has adopted agile, interactive, and innovative approaches to EUA review for all types of devices. For example, FDA developed the umbrella EUA approach to efficiently authorize multiple devices of the same type meeting the same criteria. The Agency has also issued 28 guidance documents (including 17 revisions) outlining policies to help expand the availability of medical devices needed in response to COVID-19. For example, developers of certain tests offered their tests, upon validation and notification to FDA prior, to issuance of an EUA during Agency review of the EUA request. Further, FDA made several improvements to our EUA review processes to make the most efficient use of our resources, including establishing a front-end triage process to identify devices that would have the greatest impact on the public health. These improvements incorporate the latest information on device availability and shortages, prioritizing novel or critical devices not yet available on the market or those that would address significant device shortages.
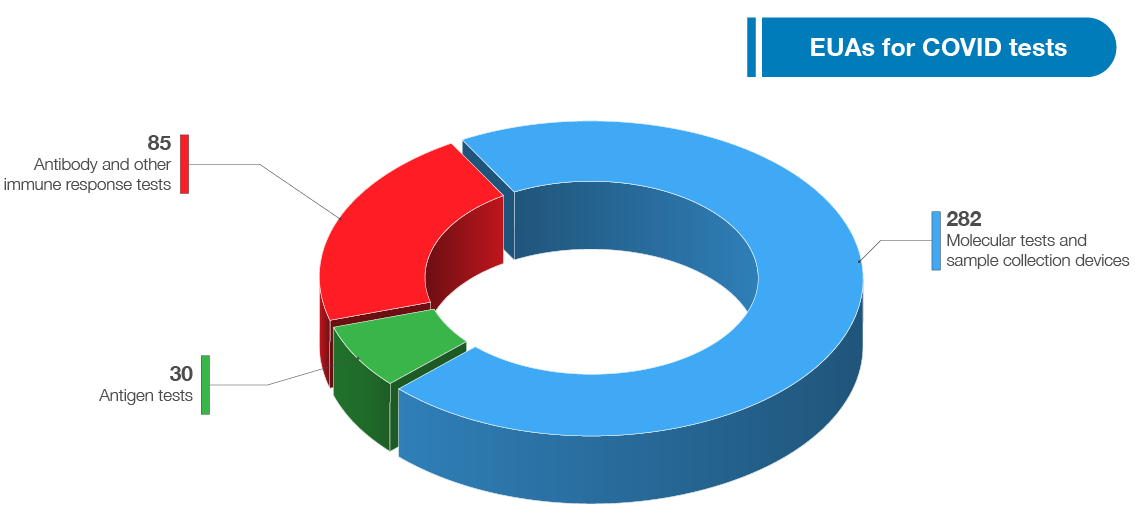
As of July 13, 2021, FDA has authorized 397 tests and sample collection devices for SARS-CoV-2. As noted in the graphic below, these include 282 molecular tests and sample collection devices, 85 antibody and other immune response tests, and 30 antigen tests. Among these are 11 diagnostic tests that can be run at home (three molecular and eight antigen tests), seven of which do not require a prescription. We have also authorized 18 tests for serial screening programs (11 antigen and seven molecular). The volume and variety of available tests is a testament to FDA’s support of innovative test design and our commitment to public health.
2020년 초부터 FDA는 모든 유형의 장치에 대해 EUA 심사에 민첩하고 대화형적이며 혁신적인 접근 방식을 채택해 왔습니다. 예를 들어, FDA는 동일한 유형의 여러 장치를 동일한 기준에 따라 효율적으로 승인하기 위해 포괄 EUA 접근 방식을 개발했습니다. 기관은 또한 COVID-19에 대응하여 필요한 의료기기의 가용성을 확대하는 데 도움이 되는 정책을 개략적으로 설명하는 28개의 지침 문서(17개 개정 포함)를 발행했다. 예를 들어, 특정 테스트의 개발자는 검증 및 통보에 따라 기관이 EUA 요청을 검토하는 동안 EUA를 발급하기 전에 FDA에 테스트를 제공했습니다. 또한, FDA는 공공 보건에 가장 큰 영향을 미치는 장치를 식별하기 위한 프런트 엔드 분류 프로세스를 수립하는 등 우리의 자원을 가장 효율적으로 사용하기 위해 EUA 검토 프로세스를 몇 가지 개선했습니다. 이러한 개선 사항에는 장치 가용성과 부족에 대한 최신 정보가 포함되어 있으며, 아직 시장에 출시되지 않은 새로운 또는 중요한 장치 또는 심각한 장치 부족을 해결할 수 있는 장치의 우선 순위가 지정되어 있습니다.
2021년 7월 13일 현재 FDA는 SARS-CoV-2에 대해 397개의 검사 및 검체 채취 장치를 승인했습니다. 아래 그래픽에서 언급한 바와 같이, 여기에는 282개의 분자 검사 및 검체 채취 장치, 85개의 항체 및 기타 면역 반응 검사, 30개의 항원 검사가 포함됩니다. 이 가운데 집에서 실행할 수 있는 진단검사 11건(분자 3건, 항원 8건)이 있는데 이 중 7건은 처방이 필요 없다. 또한 직렬 검사 프로그램(항원 11개 및 분자 7개)에 대해 18개의 검사를 승인했습니다. 이용 가능한 테스트의 양과 다양성은 FDA가 혁신적인 테스트 디자인을 지원하고 공중 보건에 대한 우리의 노력을 증명합니다.
health.
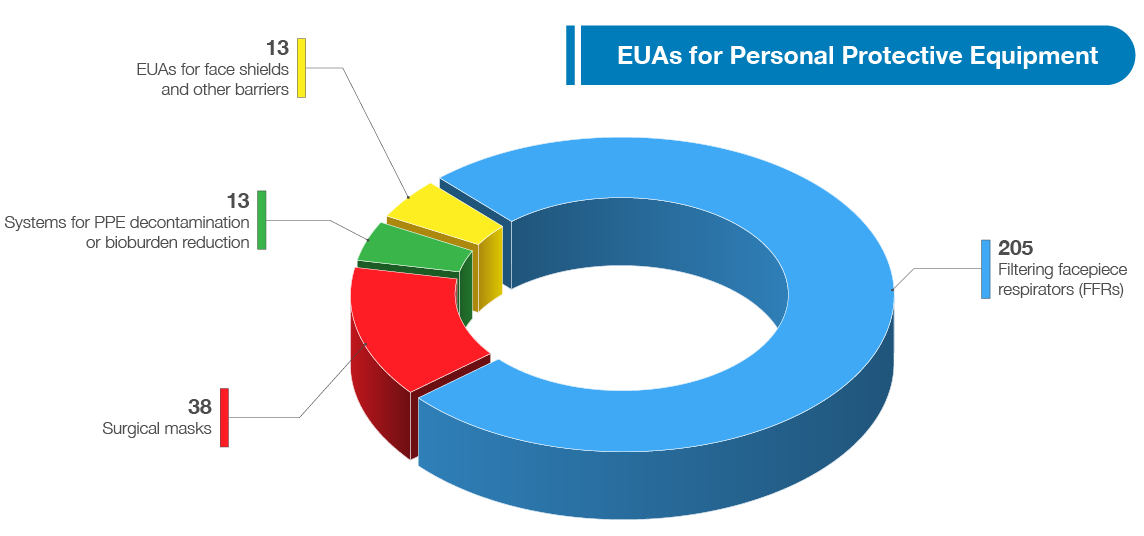
FDA has authorized a wide variety of other medical devices for use in combating the pandemic, including a wide range of personal protective equipment (PPE), ventilators, and other therapeutic devices. As of July 13, 2021, FDA has authorized 270 PPE devices including 39 surgical masks, and has authorized 205 filtering facepiece respirators (FFRs), 13 systems for PPE decontamination or bioburden reduction at the time there was a need for these types of devices due to PPE shortages,3 and 13 EUAs for face shields and other barriers intended to protect the user from bodily fluids, liquid splashes, or potentially infectious materials (see related graphic below). In addition to granting EUAs, FDA has also cleared, through its premarket notification pathway, over 250 PPE 510(k)s.
FDA recognizes that medical devices, particularly tests, will continue to play an important role in the next phase of the pandemic response. The Agency is continuing to monitor its policies, the marketplace, and national needs, and will continue to adapt as the circumstances of the evolving pandemic warrant.
FDA는 광범위한 개인 보호 장비(PPE), 인공호흡기 및 기타 치료 장비를 포함하여 전염병 퇴치에 사용할 수 있는 다양한 의료 기기를 승인했습니다. 2021년 7월 13일 현재 FDA는 39개의 수술용 마스크를 포함한 270개의 PPE 장치를 승인했으며, 205개의 여과 페이스피스 호흡기(FFR), PPE 오염 제거 또는 바이오 부담 감소를 위한 시스템 13개, 페이스 실드 및 기타 장벽에 대한 3개 및 13개의 EUA를 승인했다.체액, 액체 비산 또는 잠재적으로 감염되는 물질로부터 사용자를 보호합니다(아래 관련 그래픽 참조). FDA는 EUA를 승인하는 것 외에도 250개 이상의 PPE 510(k)을 사전 시장 통보 경로를 통해 승인했다.
개인 보호 장비용 EUA, 안면 보호막 및 기타 장벽용 EUA 13개, PPE 오염 제거 또는 생물학적 부담 감소를 위한 시스템 13개, 수술 마스크 38개, 안면 보호구(FFR) 205개.
FDA는 의료기기, 특히 테스트가 전염병 대응의 다음 단계에서 계속 중요한 역할을 할 것이라고 인식하고 있다. 기관은 정책, 시장 및 국가적 요구를 지속적으로 모니터링하고 있으며, 진화하는 전염병의 상황에 따라 지속적으로 적응할 것입니다.
Human and Animal Food
Food security is national security. Thus, throughout the pandemic, FDA has worked with federal, state, and local partners, as well as industry, to help ensure a safe and adequate food supply for both people and animals.
While SARS-CoV-2 is not transmitted by food, some components of the food system experienced challenges and supply chain imbalances, particularly at the outset of the pandemic. Overall, food production and manufacturing in the U.S. has remained resilient. We continue to monitor the food supply chain systems closely to efficiently and promptly identify mitigation strategies when necessary. Early on, the pandemic caused a significant shift in where consumers were buying food. We took steps to provide temporary guidance to provide flexibility in packaging and labeling requirements to help industry redirect products manufactured for food service and institutional use to retail grocery stores, or if needed to the animal food industry so the food does not go to waste.
FDA also recognizes that food supply chain continuity and worker safety are two sides of the same coin. Thus, a robust food supply is dependent on the safety and health of the nation’s food and agricultural workforce. Along with our federal, state and local partners, we have provided best practices for food and agricultural workers, industry, and consumers on how to stay safe, and help ensure the continuity of operations in the food and agriculture critical infrastructure sector during the pandemic and now as restaurants and other retail establishments resume regular operations.
In response to the pandemic, FDA’s Office of Food Policy and Response, Center for Food Safety and Applied Nutrition, Office of Regulatory Affairs, and Center for Veterinary Medicine developed 21 Forward, a food supply chain data management tool, to help identify where risks for interruptions in the continuity of the food supply due to COVID-19 transmission among workers may be greatest. As part of 21 Forward, FDA also conducted targeted outreach to the food industry to offer additional resources and technical assistance in addressing challenges.
In collaboration with HHS, CDC, and US Department of Agriculture (USDA), data from 21 Forward have been made available to assist states with their vaccine distribution efforts for workers in the food and agriculture sectors, including migratory and seasonal agricultural workers.
인간과 동물 사료
식량 안보는 국가 안보입니다. 따라서, 전염병을 통해, FDA는 산업뿐만 아니라 연방, 주 및 지역 파트너들과 협력하여 사람과 동물 모두에게 안전하고 적절한 식량을 공급하도록 도왔다.
SARS-CoV-2는 식품에 의해 전염되지 않지만, 식품 시스템의 일부 구성 요소는 특히 대유행 초기에 도전과 공급망 불균형을 겪었다. 전반적으로 미국의 식품 생산과 제조업은 회복세를 보이고 있다. 우리는 식품 공급망 시스템을 지속적으로 면밀히 모니터링하여 효율적이고 신속하게 완화 전략을 파악합니다. 초기에 전염병은 소비자들이 식품을 구매하는 곳에서 중요한 변화를 일으켰다. 우리는 식품 서비스 및 제도적 사용을 위해 제조된 제품을 소매 식료품점으로 전환하거나 필요한 경우 식품이 낭비되지 않도록 동물 식품 산업에 제공하는 데 도움을 주기 위해 포장 및 라벨 요구 사항에 유연성을 제공하기 위한 임시 지침을 제공하기 위해 조치를 취했습니다.
FDA도 식품 공급망 연속성과 근로자 안전성이 동전의 양면이라는 점을 인정하고 있다. 따라서, 강력한 식품 공급은 국가 식품 및 농업 인력의 안전과 건강에 달려 있다. 우리는 연방, 주 및 지역 파트너들과 함께 식품 및 농업 종사자들, 산업 및 소비자들에게 안전을 유지하는 방법에 대한 모범 사례를 제공했으며, 전염병 발생 시와 현재 식당 및 기타 소매 업소가 재개됨에 따라 식품 및 농업에 중요한 인프라 부문의 지속적인 운영을 보장하는 데 도움을 주었다. 정기 수술.
이에 FDA 식품정책대응센터, 식품안전응용영양센터, 규제사무소, 수의학센터 등이 식품공급망 데이터 관리 도구인 21포워드를 개발, COVID-19 트랜으로 인한 식품공급 중단의 위험성을 파악했다.노동자들 사이의 임무가 가장 클 수 있다. FDA는 21 Forward의 일환으로 식품 산업에 대한 표적 지원 활동을 실시하여 당면 과제를 해결하기 위한 추가 자원과 기술 지원을 제공하기도 했습니다.
HHS, CDC, 미국 농무부(USDA)와 협력하여 21 Forward의 데이터는 철새 농업 및 계절 농업 종사자를 포함한 식품 및 농업 분야 종사자를 위한 주 정부의 백신 보급 노력을 지원하기 위한 것이다.
FDA’s Coordinated Outbreak Response and Evaluation team has been working throughout the pandemic, is fully staffed, and on the job looking for signs of foodborne illness outbreaks and initiating responses as needed. FDA’s Center for Veterinary Medicine is also monitoring the animal food supply and initiating needed responses, working closely with other veterinary diagnostic laboratories in its Veterinary Laboratory Investigation and Response Network (VET-LIRN). In terms of inspectional work, FDA investigators continue to conduct mission-critical inspections domestically and abroad, including inspections and investigations in response to foodborne outbreaks during the pandemic. FDA transitioned to standard operations for domestic surveillance inspections in July 2021. Additionally, our import investigators and laboratory analysts continue to work on-site by:
- Staffing our ports of entry, helping to ensure the efficient distribution and safety of the nation’s imported food supply; and
- Conducting examinations, sample collections, and laboratory analyses of imported and domestic food to ensure the safety of our nation’s food supply.
FDA continues to screen every line of every shipment of imported food entering the United States utilizing our Predictive Risk-Based Evaluation for Dynamic Import Compliance Targeting (PREDICT) tool. We adjusted the algorithm in PREDICT to place increased scrutiny on shipments from facilities where foreign inspections have been postponed. FDA has made greater use of our Foreign Supplier Verification Program (FSVP) regulation to oversee compliance with FDA Food Safety Modernization Act (FSMA) requirements. The shift to remote FSVP inspections, along with other tools utilized by the foods program, has been critical to ensuring the safety of human and animal food from foreign suppliers during the COVID-19 pandemic. Since March 26, 2020, FDA has conducted 1,888 FSVP inspections. Since March 2020, FDA has refused approximately 8,469 lines of imported food products. FDA will continue to target and refuse human and animal foods that are unsafe, misbranded, or may cause a serious health concern for the public.
FDA continues to closely monitor the overall safety of the nation’s food supply, in collaboration with CDC, USDA, U.S. Customs and Border Protection (CBP) and our state and local partners, to protect consumers from foods contaminated with pathogens.
One year ago, FDA announced the New Era of Smarter Food Safety Blueprint outlining the Agency’s plans over the next decade to create a more digital, traceable, and safer food system. We have learned from our response as an Agency to the pandemic that there is an accelerated need for certain goals in this blueprint, especially those involving supply chain continuity and resilience, modernized inspectional approaches, and strengthening food safety infrastructures with regulatory partners.
FDA의 공동 발병 대응 및 평가 팀은 전 세계적 유행병인 식인성 질병 발생의 징후를 찾고 필요에 따라 대응책을 마련하기 위해 전력을 다하고 있습니다. FDA의 수의학센터도 동물사료 공급을 모니터링하고 필요한 반응을 이끌어내고 있으며, 수의학 연구소 조사 및 대응 네트워크(VET-LIRN)의 다른 수의학 진단 연구소와 긴밀히 협력하고 있다. 검사 업무와 관련하여, FDA 조사관들은 대유행 기간 동안 식인성 발생에 대한 검사 및 조사 등 국내외에서 미션 크리티컬 검사를 계속하고 있다. FDA는 2021년 7월 국내 감시 검사를 위한 표준 운영으로 전환했다. 또한 NAT의 수입 조사원과 실험실 분석가는 다음을 통해 현장에서 계속 일하고 있습니다.
•국내 수입 식품 공급의 효율적인 유통과 안전을 보장하는 입항항 인력 충원
•국내 식품 공급의 안전성을 보장하기 위해 수입 및 국내 식품에 대한 검사, 시료 채취 및 실험실 분석 실시
FDA는 동적 수입 준수 목표(PREDIC) 도구를 사용하여 미국에 들어오는 모든 수입 식품의 출하 라인을 지속적으로 검사하고 있습니다. 우리는 해외 검사가 연기된 시설에서 출하되는 것에 대한 정밀 조사를 증가시키기 위해 PRECED의 알고리즘을 조정했습니다. FDA는 FDA 식품안전현대화법(FSMA) 요건 준수를 감독하기 위해 FSVP(Foreign Supplier Verification Program) 규정을 더 많이 활용했습니다. 식품 프로그램이 활용하는 다른 도구들과 함께 원격 FSVP 검사로의 전환은 COV-19 전염병 동안 외국 공급업체로부터 사람과 동물성 식품의 안전을 보장하는 데 있어 매우 중요했습니다. FDA는 2020년 3월 26일부터 1,888건의 FSVP 검사를 실시했다. FDA는 2020년 3월부터 약 8,469개 라인의 수입 식품을 거부해왔다. FDA는 안전하지 않거나, 상표가 잘못되었거나, 대중들에게 심각한 건강 문제를 야기할 수 있는 사람과 동물성 식품을 지속적으로 대상으로 삼을 것입니다.
FDA는 질병에 오염된 식품으로부터 소비자를 보호하기 위해 CDC, USDA, 미국 세관국경보호국(CBP), 주 및 현지 파트너와 협력하여 식품 공급의 전반적인 안전성을 면밀히 모니터링하고 있습니다.
1년 전, FDA는 보다 디지털화되고, 추적 가능하며, 안전한 식품 시스템을 만들기 위한 향후 10년 동안 식품의약국의 계획을 요약한 '더 스마트한 식품 안전 청사진의 새로운 시대'를 발표했다. 우리는 이 청사진, 특히 공급망 연속성 및 복원력, 현대화된 검사 접근법, 규제 파트너와의 식품 안전 인프라 강화와 관련된 특정 목표에 대한 가속화된 필요성이 이 청사진에 대한 기관으로서의 대응을 통해 알게 되었습니다.
Inspections, Compliance, and Protecting the Medical Supply Chain
Similar to their work protecting the food supply, import investigators have been on site protecting the medical supply chain at our ports of entry, courier facilities, and the international mail facilities (IMFs) throughout the pandemic. Through continued vigilance, FDA has prevented unsafe and unauthorized pharmaceuticals and other medical products from entering the country. Since March 2020, with the cooperation of and in coordination with CBP, FDA has received and destroyed almost 60,000 products, totaling over 11,093,868 capsules, pieces, and tablets of illegal or unapproved drugs.
Since March 2020, FDA has refused approximately 94,725 lines of imported violative medical products. We have maintained the same level of pre-pandemic screening for imported products. However, FDA has focused examinations on COVID-19 relief supplies to ensure compliant products are expedited while maintaining our commitment to refusing imported medical products that are unsafe, misbranded, unapproved, counterfeit, or may cause serious illness or injury to the public. In fact, our import and domestic officers have evaluated donations of shipments destined for the Federal Emergency Management Agency (FEMA) and met the first vaccines (Pfizer Belgium) on their arrival into the United States in December 2020 to ensure proper transport, storage, and reconciliation of products. Our officers also assisted with expediting the importation of other compliant vaccine-related shipments.
Despite pausing domestic and foreign surveillance inspections in March 2020 to safeguard the health and well-being of our staff, as well as employees at facilities we inspect, our investigators continued to conduct mission-critical inspections both domestically and abroad to ensure FDA-regulated industries were meeting applicable FDA requirements. In July 2020, FDA resumed prioritized domestic inspections. To arm our investigators with the most reliable and accurate information, FDA developed a rating system to assist in determining when and where it was safest to conduct prioritized domestic inspections.
검사, 컴플라이언스 및 의료 공급망 보호
식품 공급을 보호하는 작업과 마찬가지로 수입 조사관들은 전 세계적으로 우리의 수입항, 택배 시설 및 국제우편시설(IMF)에서 의료 공급망을 보호하고 있습니다. FDA는 지속적인 감시를 통해 안전하지 않고 허가되지 않은 의약품과 다른 의약품들이 국내에 들어오는 것을 막았다. FDA는 2020년 3월부터 CBP의 협력 및 협력으로 총 11,093,868개 이상의 불법 또는 미승인 의약품의 약 6만 개에 달하는 제품을 공급받아 폐기했다.
FDA는 2020년 3월부터 약 94,725개 라인의 위반성 의약품 수입을 거부해왔다. 우리는 수입 제품에 대해서도 동일한 수준의 전염병 전 검사를 유지해 왔습니다. 그러나 FDA는 안전하지 않거나, 상표가 잘못되었거나, 승인되지 않았거나, 위조되었거나, 대중들에게 심각한 질병이나 부상을 초래할 수 있는 수입 의약품에 대한 거부 약속을 유지하면서 준수 제품이 신속하게 공급되도록 하기 위해 COVID-19 구제 물자에 대한 검사를 집중해 왔습니다. 실제로, 우리의 수입 및 국내 담당자들은 연방방재청(FEMA)으로 향하는 선적물들의 기부금을 평가해 왔으며, 제품의 적절한 운송, 보관 및 조정을 위해 2020년 12월 미국에 도착하자마자 첫 백신(Pfizer Belgium)을 만났습니다. 우리 담당자들은 또한 다른 규격의 백신 관련 선적품의 수입을 가속화하는 데 도움을 주었습니다.
2020년 3월 우리 직원의 건강과 안녕을 지키기 위해 국내외 감시 검사를 일시 중단했음에도 불구하고, 우리 조사관들은 FDA 규제 산업이 적용 가능한 FDA 요건을 충족하고 있는지 확인하기 위해 국내외 미션 크리티컬 검사를 계속 수행했습니다. 2020년 7월, FDA는 국내 검사의 우선 순위를 다시 정했다. FDA는 가장 신뢰할 수 있고 정확한 정보를 우리의 조사관들에게 제공하기 위해 우선적인 국내 검사를 언제 어디서 실시하는 것이 가장 안전한지를 결정하는 데 도움을 주는 등급 시스템을 개발했습니다.
On May 5, 2021, FDA issued a report titled, “Resiliency Roadmap for FDA Inspectional Oversight,” outlining the Agency’s inspectional activities during the COVID-19 pandemic and its detailed plan to move toward a more consistent state of operations, including FDA’s priorities related to this work going forward.
The report outlines inspections that the Agency was unable to complete during the past year due to travel restrictions or inability to ensure the safety of our workforce or the workforces within the industries the Agency regulates. The report also outlines the number of mission-critical inspections FDA completed during that time, such as inspections of facilities for which there was a drug shortage, inspections needed for the approval of novel drugs or drugs related to the potential treatment of COVID-19, support of pre-market and pre-license applications, and response to foodborne disease outbreaks or other food safety risks such as food contaminated with pathogens.
Of note:
- From March 2020 through March 2021, FDA conducted a total of 821 mission-critical inspections, including 29 in foreign countries.
- Additionally, the Agency conducted a total of 777 prioritized domestic inspections since resumption of that work in July 2020.
- Of the more than 13,500 applications for medical product approval or authorization received since March 2020, only approximately 68 applications have been delayed due to the inability to conduct inspections — and a majority of these applications are not deemed mission-critical.
Additionally, the Resiliency Roadmap Report outlines FDA’s continued, successful use of alternative tools and approaches where inspections were or are not currently feasible, including remote interactive evaluations (e.g., remote livestreaming video of operations, teleconferences, or screen sharing), making record requests to regulated establishments, and leveraging information from trusted regulatory partners. For example, FDA made over 1,300 record requests to human and animal drug and biological product manufacturers, to support on-time regulatory decision actions. In addition, since March 2020, FDA has added products from 18 firms to import alerts as subject to detention without physical examination, based on records requests in advance or in lieu of inspection that FDA submitted pursuant to section 704(a)(4) of the FD&C Act.
Notably, FDA’s bioresearch monitoring program staff have conducted more than 130 remote interactive evaluations that were directly used for application decisions.4 The new tool was incentivized for and supported by industry and continues to provide the Agency with valuable information to assist with risk-based targeting for inspections. FDA recognizes that remote approaches do not replace inspections, and that there are situations where only an inspection is appropriate based on risk and history of compliance with FDA regulations.
2021년 5월 5일, FDA는 "FDA 검사 감독을 위한 복원 로드맵"이라는 보고서를 발표하여, COVID-19 대유행 시 기관의 검사 활동과 이 작업과 관련된 FDA의 우선순위를 포함하여 보다 일관된 운영 상태로 나아갈 세부 계획을 개략적으로 설명했습니다.
이 보고서에서는 여행 제한이나 기관에서 규제하는 산업 내 인력 또는 인력의 안전을 보장할 수 없어 기관이 지난 1년 동안 완료할 수 없었던 검사를 개략적으로 설명합니다. 보고서는 또한 약품 부족이 있었던 시설에 대한 검사, 잠재적인 치료제인 COVID-19와 관련된 새로운 의약품 또는 의약품의 승인에 필요한 검사, 사전 시장 및 사전 라이선스 신청 지원, FDA 대응 등 그 기간 동안 완료된 업무상 중요한 검사 횟수도 개략적으로 기술하고 있다.식인성 질병 발생 또는 병원균에 오염된 식품과 같은 기타 식품 안전 위험.
주의사항:
•FDA는 2020년 3월부터 2021년 3월까지 총 821건의 업무상 중요한 검사를 실시했으며, 여기에는 해외 29건이 포함된다.
• 또한, 해당 기관은 2020년 7월 작업 재개 이후 총 777건의 우선순위 국내 검사를 실시했다.
• 2020년 3월 이후 접수된 13,500건이 넘는 의료 제품 승인 또는 승인 신청 중 약 68건만이 검사를 수행할 수 없어 지연되었으며, 이러한 신청 중 대다수는 업무상 중요한 것으로 간주되지 않습니다.
또한 복원력 로드맵 보고서에는 원격 인터렉티브 평가(예: 원격 라이브 스트리밍 운영, 전화 회의 또는 화면 공유)를 포함하여 현재 검사가 실현 가능하거나 가능하지 않은 대체 도구와 접근 방식이 FDA에서 지속적으로 성공적으로 사용되고 있으며 규제 기관에게 레코드 요청을 하는 방법이 요약되어 있습니다.ts, 신뢰할 수 있는 규제 파트너의 정보 활용. 예를 들어, FDA는 제때에 규제 결정 조치를 지원하기 위해 인간과 동물 의약품 및 생물 제품 제조업체에 1,300개 이상의 기록 요청을 했습니다. 또한 FDA는 2020년 3월부터 FDA가 FD&C법 제704조(a)(4)항에 따라 제출한 사전 또는 검사대신 18개 업체의 제품을 구류대상으로 물리적 검사 없이 수입할 수 있도록 추가해 왔다.
특히, FDA의 생물 연구 모니터링 프로그램 담당자는 130개 이상의 원격 상호작용 평가를 수행했으며, 이는 애플리케이션 결정에 직접 사용되었습니다.4 이 새로운 도구는 업계로부터 인센티브를 받고 지원받았으며, 기관에게 검사에 대한 위험 기반 표적을 지원할 수 있는 귀중한 정보를 계속 제공하고 있습니다. FDA는 원격접근법이 검사를 대체하지 않으며, FDA 규정 준수 이력과 위험성에 따라 검사만 적합한 상황이 있다고 인식하고 있다.
The Resiliency Roadmap Report further outlines the ongoing steps the Agency is taking to resume standard operational levels of inspection activities, including how it intends to prioritize domestic and foreign inspections that were not performed during the pandemic. The plan highlights a variety of possible scenarios given the continued uncertainty of the trajectory of the ongoing COVID-19 pandemic. On July 1, FDA activated the base-case scenario (COVID response continues on current trend) to transition to standard operations for domestic inspections and other operational work, as detailed in the report. Inspections considered critical to FDA’s mission will remain the primary focus. When planning routine surveillance inspections, the Agency will prioritize higher-risk establishments. This means that postponed inspections will be prioritized based on risk and conducted over a longer period of time, ultimately increasing the amount of time between inspections of certain lower-risk facilities in order to focus on products that present the greatest risk to public health.
The Agency will also soon begin a multi-year modernization effort to further transform our data enterprise platforms and cross-program interoperability infrastructure to better support innovation related to its regulatory oversight role. This includes adopting technology to support regulatory assessments to improve our remote receipt, review, and analysis of industry data and records, and improve remote interactions with industry entities to be easier, more efficient, more consistent, and more secure. This modernization effort will include a review of inspectional approaches using next-generation assessment technologies and improvements. FDA is also establishing an Agency-wide Inspectional Affairs Council that will provide for coordination of inspection approaches and assessment processes. The Agency intends to share more information on these efforts as this work progresses. FDA will continue to leverage and maximize every available tool and resource to meet its inspectional responsibilities, while achieving optimal public health outcomes.
복원력 로드맵 보고서에는 기관이 전염병 기간 동안 수행되지 않은 국내외 검사의 우선 순위를 포함하여 표준 운영 수준의 검사 활동을 재개하기 위해 현재 진행 중인 단계가 요약되어 있습니다. 이 계획은 진행 중인 COVID-19 전염병의 궤적이 지속적으로 불확실하다는 점을 감안할 때 가능한 다양한 시나리오를 강조한다. FDA는 1일 보고서에서 상세히 설명한 대로 국내 검사 및 기타 운영 업무를 위한 표준 업무로 전환하기 위한 베이스 케이스 시나리오(COVID 대응 지속)를 활성화했다. FDA의 임무에 매우 중요한 것으로 여겨지는 검사는 주요 관심사로 남을 것이다. 일상적인 감시 검사를 계획할 때, 기관은 위험성이 높은 시설에 우선순위를 부여합니다. 이는 공공보건에 가장 큰 위험이 있는 제품에 집중하기 위해 지연된 검사를 우선시하고 장기간에 걸쳐 실시해 궁극적으로 특정 저위험시설 점검 간격을 늘린다는 뜻이다.
또한 규제 감독 역할과 관련된 혁신을 보다 효과적으로 지원하기 위해 데이터 엔터프라이즈 플랫폼과 교차 프로그램 상호 운용성 인프라를 더욱 혁신하기 위한 다년간의 현대화 노력도 곧 시작할 예정입니다. 여기에는 규제 평가를 지원하는 기술을 채택하여 업계 데이터 및 레코드의 원격 수신, 검토 및 분석을 개선하고, 업계 기업과의 원격 상호 작용을 보다 쉽고, 효율적이고, 일관되고, 보다 안전하게 수행하는 것이 포함됩니다. 이러한 현대화 노력에는 차세대 평가 기술과 개선 사항을 이용한 검사 접근 방식에 대한 검토가 포함될 것입니다. FDA는 또 검사 접근 방식과 평가 과정을 조율할 기관 전반의 검사 위원회를 설립한다. 기관은 이 작업이 진행됨에 따라 이러한 노력에 대한 더 많은 정보를 공유하고자 합니다. FDA는 최적의 공중 보건 결과를 달성하는 동시에 검사 책임을 이행하기 위해 사용 가능한 모든 도구와 자원을 지속적으로 활용하고 최대화할 것입니다.
Compliance and Enforcement
FDA exercises its regulatory authority by, among other things, issuing warning letters and pursuing civil and criminal actions against firms and individuals who do not comply with regulatory requirements, including those selling unapproved products with false or misleading claims that the products prevent, treat, mitigate, diagnose, or cure COVID-19. In March 2020, FDA launched Operation Quack Hack, which leverages Agency expertise and advanced analytics to protect consumers from fraudulent medical products, including unproven cures, illegitimate test kits, and substandard or counterfeit respirators. FDA has sent thousands of abuse complaints to domain name registrars and internet marketplaces. The Agency also has sent more than 241 warning letters to sellers of unproven COVID-19 products. Working with the Department of Justice (DOJ), FDA has sought and obtained preliminary injunctions that require defendants to halt the sale of fraudulent products claiming to treat or prevent COVID-19, including one product, “Miracle Mineral Solution,” that, when used as directed, is equivalent to industrial bleach.
In addition, FDA’s Office of Criminal Investigations (OCI), working with other federal and local law enforcement agencies, investigated a hospital pharmacist who tampered with COVID-19 vaccine doses at a Wisconsin hospital where he worked. On two successive overnight shifts at the hospital in late December 2020, the pharmacist purposefully removed a box of COVID-19 vaccine vials manufactured by Moderna—which must be stored at specific temperatures for specific time periods to remain viable—from the hospital’s refrigeration unit intending to render the vaccines inert and no longer effective. The pharmacist acknowledged that after leaving the vaccines out for several hours each night, he returned them to the refrigerator to be used in the hospital’s vaccine clinic the following day. Before the full extent of his conduct was discovered, 57 people received doses of the vaccine from these vials. In January 2021, the pharmacist pled guilty to two counts of attempting to tamper with consumer products with reckless disregard for the risk that another person will be placed in danger of death or bodily injury. He has been sentenced to three years imprisonment, followed by three years of supervised release, and he must pay approximately $83,800 in restitution to the hospital.
In addition, FDA investigators remain on the front lines at ports of entry, quickly examining, reviewing, and sampling import entries, and refusing admission where appropriate. We protect the supply chain in two equally critical ways, by helping to ensure that 1) safe products are coming in; and 2) illegal, dangerous, and fraudulent products do not get into the country. These efforts include partnering with CBP in establishing satellite laboratories at selected IMFs with scientists using state-of-the-art screening tools to rapidly identify unapproved, counterfeit and illicit products.
컴플라이언스 및 시행
FDA는 무엇보다도 제품이 COVID-1을 예방, 치료, 완화, 진단 또는 치료하는 허위 또는 오해의 소지가 있는 주장과 함께 승인되지 않은 제품을 판매하는 기업 및 개인에 대해 경고장을 발행하고 민형사상 조치를 취함으로써 규제 권한을 행사합니다.9. FDA는 2020년 3월, 검증되지 않은 치료제, 불법 테스트 키트, 규격 미달 또는 위조 호흡기 등 사기성 의약품으로부터 소비자를 보호하기 위해 에이전시의 전문 지식과 고급 분석을 활용하는 Quack Hack 작전을 개시했습니다. FDA는 도메인 네임 등록자와 인터넷 마켓플레이스에 수천 건의 악용 민원을 보냈다. 이 기관은 또한 입증되지 않은 COVID-19 제품의 판매자들에게 241건 이상의 경고장을 보냈다. 미 식품의약국은 법무부와 협력해 피고인들이 지시에 따라 사용하면 산업용 표백제와 맞먹는 제품인 '미라클 미네랄 솔루션' 1종을 포함해 COVID-19를 치료하거나 예방한다고 주장하는 사기성 제품의 판매를 중단하도록 요구하는 사전 가처분 명령을 얻어냈다.
이와 함께 FDA 범죄수사국(OCI)은 다른 연방정부 및 지방법 집행기관과 함께 자신이 근무하던 위스콘신주 병원에서 COVID-19 백신 투여량을 조작한 병원 약사를 조사했다. 2020년 12월 말 병원에서 연속 2번의 야간 근무로 약사는 모데나가 제조한 COVID-19 백신 병 상자를 의도적으로 제거했다. 이 병은 특정 기간 동안 보관해야 사용할 수 있다.효과적이다. 이 약사는 매일 밤 몇 시간씩 백신을 방치한 뒤 다음날 병원 백신 클리닉에서 사용할 수 있도록 냉장고에 반납했다고 인정했다. 그의 행동의 전모가 밝혀지기 전, 57명의 사람들이 이 약병들로부터 백신을 맞았다. 약사는 2021년 1월 다른 사람이 사망이나 신체상해의 위험에 처할 위험을 무시하고 소비재를 조작하려 한 혐의 2건에 대해 유죄를 선고했다. 그는 징역 3년에 집행유예 3년을 선고받았고, 그 후 3년간 감시를 받으며 병원에 약 8만3,800달러를 배상해야 한다.
또한 FDA 조사관들은 수입항구의 최전선에 남아 신속하게 수입품목을 검사, 검토 및 샘플링하고, 적절한 경우 입원을 거부합니다. NAT은 1) 안전한 제품이 들어오는 것과 2) 불법, 위험 및 사기성 제품이 국내에 유입되지 않도록 함으로써 동일하게 중요한 두 가지 방식으로 공급망을 보호합니다. 이러한 노력에는 CBP와 협력하여 엄선된 IMF에 위성 연구소를 설립하는 것, 승인되지 않은 위조 및 불법 제품을 신속하게 식별하기 위한 첨단 검사 도구를 사용하는 과학자들과의 협력도 포함된다.
In March 2020, OCI, with the help of domestic law enforcement partners and foreign counterparts in the United Kingdom, led the investigation of fraudulent COVID-19 “treatment kits” that were falsely declared as “water treatment.” Import examination of these shipments found misbranded “kits” intended to treat SARS-CoV-2. As a result of this investigation, a British national was charged and arrested for shipping mislabeled and unapproved products. Subsequently, in April 2020, FDA intercepted a bulk shipment of hydroxychloroquine coming from China going to a physician in California. The physician was thereafter charged with mail fraud and making a false statement stemming from the allegations that he smuggled hydroxychloroquine from China to make his own pills and concealed the shipment from CBP by mis-declaring it as yam extract. In May 2020, FDA worked with CBP to intercept several shipments of counterfeit facemasks, with the result that they were refused and destroyed before getting into U.S. commerce.
More recently, FDA has taken steps to address hand sanitizer products that pose safety concerns, such as products that do not meet the required ethanol or isopropanol levels, or that contain or may contain toxic ingredients like methanol or 1-propanol. Regarding the latter, substantial methanol exposure can result in nausea, vomiting, headache, blurred vision, permanent blindness, seizures, coma, permanent damage to the nervous system or death. Ingesting 1-propanol can cause central nervous system depression, which can result in death. FDA has tested several hundred products using field-based and laboratory-based tools, found more than a hundred violative products, issued warnings to consumers not to use contaminated hand sanitizers, and has taken steps to help ensure that these dangerous or subpotent products do not enter domestic commerce. FDA has coordinated with CBP to identify such products, and we have listed products made by more than 40 manufacturers on import alert. FDA also placed all alcohol-based hand sanitizers from Mexico on a countrywide import alert to help stop products from entering the United States that appear to be in violation until the Agency is able to review the products. That action marked the first time the FDA has issued a countrywide import alert for any category of drug product.
OCI는 2020년 3월 영국 국내 법 집행 파트너와 외국 담당자의 도움을 받아 '물 치료'로 허위 선언된 사기성 COVID-19 '치료 키트' 수사를 주도했다. 이 선적물들의 수입 검사에서 SARS-CoV-2를 치료하기 위한 잘못된 상표의 "키트"가 발견되었습니다. 이 조사 결과, 영국 국적자가 라벨이 잘못 부착되고 승인되지 않은 제품을 배송한 혐의로 기소 및 체포되었습니다. 그 후, 2020년 4월, FDA는 중국에서 캘리포니아에 있는 의사에게 보내는 히드록시 클로로퀸의 대량 수송을 가로챘다. 이 의사는 이후 우편사기 혐의로 기소돼 중국에서 히드록시클로로퀸을 밀반입해 직접 약을 만든 뒤 야마 추출물로 오인해 CBP에서 선적물을 숨겼다는 혐의에 따른 허위 진술을 했다. FDA는 2020년 5월 CBP와 협력해 가짜 마스크 여러 개를 가로챘고, 그 결과 미국 상거래에 들어가기 전에 거부당하고 파괴되었다.
보다 최근에 FDA는 에탄올이나 이소프로판올 수준을 충족하지 못하거나 메탄올이나 1-프로판올과 같은 독성 성분을 함유하거나 함유할 수 있는 제품 등 안전에 문제가 있는 손소독제 제품을 다루기 위한 조치를 취했습니다. 후자의 경우, 상당한 메탄올 노출은 메스꺼움, 구토, 두통, 시야 흐림, 영구 실명, 발작, 혼수, 신경계 영구 손상 또는 사망을 초래할 수 있습니다. 1-프로판올을 섭취하면 중추신경계 우울증을 일으켜 사망에 이를 수 있다. FDA는 현장 기반 및 실험실 기반 도구를 사용하여 수백 개의 제품을 테스트했으며, 100개 이상의 위반 제품을 발견했으며, 소비자들에게 오염된 손 세정제를 사용하지 말라고 경고했으며, 이러한 위험하거나 잠재적 제품이 국내 상업에 유입되지 않도록 하기 위한 조치를 취했습니다. FDA는 CBP와 이러한 제품을 식별하기 위해 협력했으며, 우리는 40개 이상의 제조업체에서 만든 제품을 수입 경계에 따라 목록화했습니다. FDA는 또한 멕시코산 모든 알코올성 손소독제를 전국적인 수입경보 발령하여, 해당 제품을 검토할 수 있을 때까지 위반으로 보이는 제품들이 미국으로 들어오는 것을 막기 위해 도움을 주었다. 이 조치는 FDA가 모든 종류의 의약품에 대해 전국적인 수입 경보를 발령한 첫 사례이다.
Medical Product Supply Chain
FDA monitors and responds to worldwide demand and supply chain disruptions for medical products caused by the COVID-19 pandemic. We work closely with manufacturers to help ensure they continue to notify the Agency of any permanent discontinuance or interruption of drug (human and animal), biological product, and device manufacturing in a timely manner and, as noted in FDA’s FY 2022 budget, we are working to better position the Agency and our health care system to assure a strong domestic supply chain in future emergencies.5
In addition to our usual communication with drug manufacturers, we work closely with healthcare and pharmacy systems, hospitals, providers, and others on the frontlines of COVID-19 patient care to identify current or emerging regional shortages of critical care drugs used to treat COVID-19.
FDA understands the significant impact shortages can have on patient care and is doing everything within our authorities to help prevent and alleviate disruptions. When we identify a shortage, we react swiftly to mitigate the impact to U.S. patients and health care professionals, and quickly share that information with the public. For example, we issued temporary policies for outsourcing facilities registered with FDA and pharmacists in state-licensed pharmacies or federal facilities, regarding the compounding of certain drugs used to treat hospitalized patients with COVID-19 when approved drugs are not available. The Agency has also published guidance to help applicants and manufacturers provide FDA with timely and informative notifications about changes in the production of certain drugs (including animal drugs) and human biological products, and urging the submission of these notifications, which may assist in our efforts to prevent or mitigate shortages of such products.
The Agency quickly identified the need to help ensure widespread access to hand sanitizers as demand spiked, while also continuing our mission to ensure these products are not contaminated by removing adulterated products from the market. FDA has published and continues to update three guidance documents designed to help facilitate the production of alcohol-based hand sanitizer in non-traditional settings such as pharmacies or distilleries. The Agency has launched several enforcement initiatives and import alerts to help stop adulterated and subpotent hand sanitizer products from getting into U.S. distribution channels.
의료 제품 공급망
FDA는 COVID-19 대유행으로 인한 의약품에 대한 전세계 수요 및 공급망 장애를 모니터링하고 대응합니다. 우리는 의약품(인간 및 동물), 생물 제품 및 장치 제조의 영구적인 중단 또는 중단을 기관에게 적시에 계속 통지할 수 있도록 제조 업체와 긴밀히 협력하고 있으며, FDA의 2022 회계연도 예산에서 언급된 바와 같이 기관과 의료 시스템의 위치를 개선하기 위해 노력하고 있습니다. 미래의 비상사태에서 강력한 국내 공급망.5
의약품 제조업체와의 일반적인 커뮤니케이션 외에도, 우리는 COVID-19 환자 진료의 최전선에서 의료 및 약국 시스템, 병원, 공급자 등과 긴밀히 협력하여 COVID-19 치료에 사용되는 중요한 치료약의 현재 또는 새로운 지역적 부족을 파악합니다.
FDA는 부족이 환자 치료에 미칠 수 있는 심각한 영향을 이해하고 있으며, 장애 예방과 완화를 위해 당국에 있는 모든 조치를 취하고 있습니다. 부족한 부분을 파악하면 신속하게 대응하여 미국 환자와 의료 전문가에게 미치는 영향을 완화하고, 신속하게 대중에게 정보를 공유합니다. 예를 들어, 승인된 약물이 없을 때 입원환자를 COVID-19로 치료하는 데 사용되는 특정 약물의 혼합과 관련하여 FDA와 주 면허 약사 또는 연방 시설에 등록된 아웃소싱 시설에 대한 임시 정책을 발행했습니다. 기관은 또한 신청자와 제조자가 특정 의약품(동물 의약품 포함)의 생산 변경에 대한 적시적이고 유익한 통지를 FDA에 제공할 수 있도록 돕고, 부족을 방지하거나 완화하기 위한 우리의 노력에 도움이 될 수 있는 이러한 통지의 제출을 촉구하는 지침을 발표했다.s 제품.
해당 기관은 수요가 급증함에 따라 손소독제에 대한 광범위한 접근을 보장하는 동시에 시장에서 불량 제품을 제거함으로써 이러한 제품이 오염되지 않도록 하기 위한 우리의 임무를 지속할 필요가 있음을 신속하게 파악했습니다. FDA는 약국이나 증류소와 같은 전통적이지 않은 환경에서 알코올 기반 손소독제의 생산을 촉진하기 위해 고안된 세 가지 지침 문서를 발표하고 계속 업데이트하고 있습니다. 이 기관은 불량 및 잠재적 손소독제 제품이 미국 유통 채널에 유입되는 것을 막기 위해 여러 가지 시행 계획 및 수입 경고에 착수했다.
Our experience with COVID-19 demonstrates that a strong domestic supply chain depends on a resilient supply chain for medical devices as well. Indeed, multiple entities across the public and private sector have important parts to play in strengthening the domestic medical device supply chain. FDA can play a critical role in identifying and preventing shortages for devices, because the Agency not only reviews and authorizes these products, but also has unique, collaborative relationships that allow direct engagement with device manufacturers, patients, distributors, healthcare organizations and other stakeholders. Even before the pandemic hit the United States, there were already problems in the supply chain due to demand for devices in other nations where COVID-19 was already prevalent. As a result, FDA began shortage mitigation activities for medical devices in January 2020 before the PHE was declared in the U.S., and months before a pandemic was declared worldwide. The Agency took several actions to rapidly respond to supply chain needs, including reassigning 130 staff to perform shortages work across CDRH and contacting over 1,000 manufacturing facilities in 12 countries in just a few weeks’ time to get as much information as possible about critical devices.
In addition, FDA has conducted horizon scanning to assess demand for devices needed to respond to the pandemic, including PPE, ventilators, diagnostic supplies, infusion pumps, and non-contact infrared thermometers; and established a rapid response team, working with field personnel to address fraudulent imports. The Agency has likewise worked to prevent and mitigate shortages of testing supplies. For example, FDA collaborated with U.S. Cotton, one of the world’s largest manufacturers of cotton swabs, to develop and produce a polyester-based swab for testing. FDA also collaborated with laboratories and clinical investigators validating potential alternative sources of control materials, transport media, and swabs. As individual developers validated these alternative components, FDA requested their permission to share their findings publicly so that others could benefit, and we posted these alternatives on our website. In this way, FDA has been serving as a clearinghouse for scientific information that the entire community can leverage to mitigate shortages and increase testing capacity. FDA continues to post this information on a rolling basis on an FAQ website so that labs have access to the latest information regarding alternative controls, transport media, extraction, instruments, and swabs.
Congress has acknowledged the importance of this work to our health care system, and we want to continue working with this committee and others to ensure FDA has the resources and authorities needed to ensure U.S. patients and health care providers have the products they need each day, and especially during public health emergencies.
또한 FDA는 PPE, 인공호흡기, 진단용품, 주입펌프, 비접촉 적외선 온도계 등 대유행 대응에 필요한 장치에 대한 수요를 평가하기 위해 수평 스캔을 실시했으며, 부정 수입을 해결하기 위해 현장 직원들과 협력하여 신속한 대응팀을 구성했습니다. 그 기관은 또한 시험용품의 부족을 예방하고 완화하기 위해 노력해왔다. 예를 들어, FDA는 세계 최대의 면봉 제조업체 중 하나인 US Cotton과 협력하여 폴리에스테르 기반의 시험용 면봉을 개발하고 생산했다. FDA는 또한 제어 물질, 운반 매체 및 면봉의 잠재적 대체 소스를 검증하는 실험실 및 임상 조사자들과 협력했습니다. 개별 개발자들이 이러한 대체 구성요소를 검증함에 따라 FDA는 다른 개발자들이 이익을 볼 수 있도록 그들의 연구 결과를 공개적으로 공유할 수 있도록 허가를 요청했고, 우리는 이러한 대안을 우리의 웹사이트에 게시했습니다. 이런 식으로 FDA는 전체 커뮤니티가 부족을 완화하고 테스트 용량을 늘리기 위해 활용할 수 있는 과학 정보의 정보 보관소 역할을 해왔다. FDA는 이 정보를 FAQ 웹사이트에 지속적으로 게시하여 연구소가 대체 제어, 운송 매체, 추출, 기구 및 면봉에 대한 최신 정보에 액세스할 수 있도록 합니다.
의회는 우리의 의료 시스템에 대한 이 작업의 중요성을 인정해 왔으며, 우리는 FDA가 미국 환자와 의료 제공자들이 매일, 그리고 특히 공중 보건 비상시 필요한 제품을 보유하도록 보장하는 데 필요한 자원과 권한을 가지고 있는지 확인하기 위해 이 위원회와 다른 기관들과 계속 협력하기를 원합니다.
Conclusion
FDA continues to advance its mission to protect and promote public health by ensuring the safety of human and animal food, and the safety and effectiveness of medical products. We take our public health mandate very seriously and will continue to work each day to end this pandemic. We continue to communicate with the American public and make regulatory decisions based on data and sound science. I look forward to continuing to work with the Committee on these efforts and thank you again for the opportunity to testify today.
결론
FDA는 사람과 동물성 식품의 안전성, 의약품의 안전성 및 효과성을 보장하여 공공보건을 보호하고 증진하기 위한 사명을 지속적으로 진척시키고 있습니다. 우리는 공중 보건의 의무를 매우 진지하게 받아들이고 있으며 이 전염병을 종식시키기 위해 매일 노력할 것입니다. 우리는 미국 대중과 지속적으로 소통하고 데이터와 건전한 과학을 바탕으로 규제 결정을 내립니다. 나는 이러한 노력에 대해 위원회와 계속 일할 수 있기를 기대하며 오늘 증언할 수 있는 기회를 주셔서 다시 한번 감사드립니다.
게시글 찬성/반대
- 3추천
- 1반대
운영배심원의견
운영배심원의견이란
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.







댓글목록