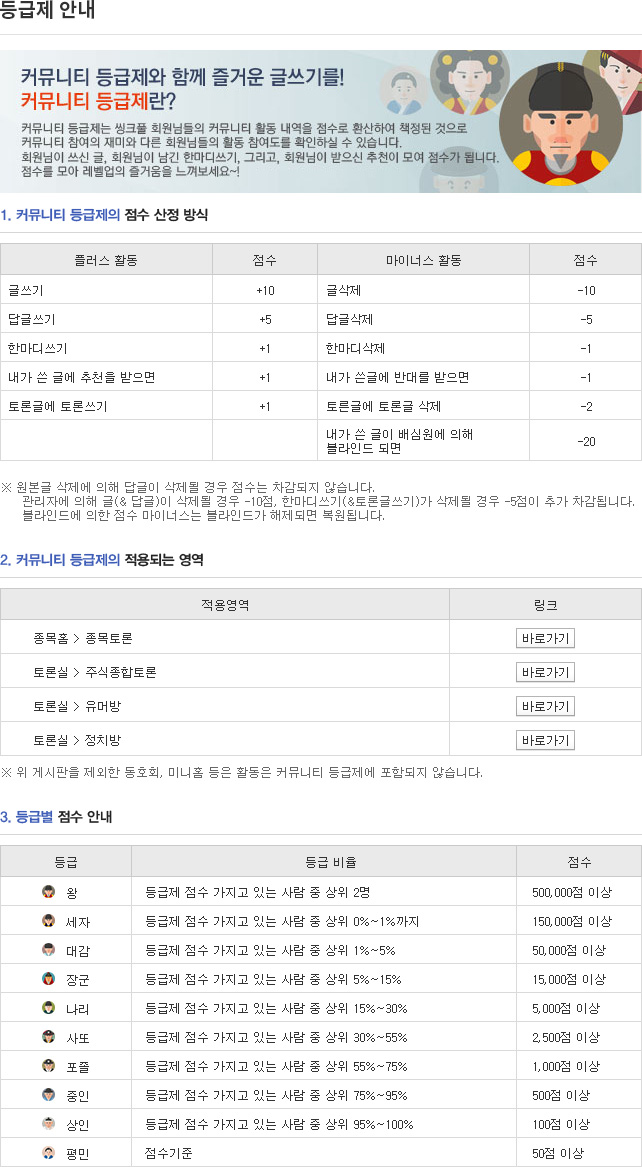
종목토론카테고리
게시판버튼
게시글 제목
나파모가 메르스(코로나)의 복제를 억제하는데 카모스타트보다 더 효율적이다.게시글 내용
Interestingly, nafamostat was found to be more effective than camostat in blocking MERS‐CoV entry and replication in host cells.
-----------------------------
나파모가 메르스(코로나)의 복제를 억제하는데 카모스타트보다 더 효율적이다.
El Shimy et al. 2020(12월 23일 등재)
Targeting host cell proteases as a potential treatment strategy to limit the spread of SARSCoV2 in the respiratory tract
Abstract
As the death toll of Coronavirus disease 19 (COVID19) continues to rise worldwide, it is imperative to explore novel molecular mechanisms for targeting SARSCoV2. Rather than looking for drugs that directly interact with key viral proteins inhibiting its replication, an alternative and possibly addon approach is to dismantle the host cell machinery that enables the virus to infect the host cell and spread from one cell to another. Excellent examples of such machinery are host cell proteases whose role in viral pathogenesis has been demonstrated in numerous coronaviruses. In this review, we propose two therapeutic modalities to tackle SARSCoV2 infections; the first is to transcriptionally modulate the expression of cellular proteases and their endogenous inhibitors and the second is to directly inhibit their enzymatic activity. We present a nonexhaustive collection of clinically investigated drugs that act by one of these mechanisms and thus represent promising candidates for preclinical in vitro testing and hopefully clinical testing in COVID19 patients.
Abbreviations
-
- ARDS
-
- acute respiratory distress syndrome
-
- COVID19
-
- Coronavirus disease 19
-
- SARSCoV2
-
- syndrome coronavirus2
-
- WHO
-
- World Health Organization?
코로나 바이러스 질병 19(COVIDα19)의 사망자 수가 전 세계적으로 계속 증가하고 있기 때문에 사스 CoVα2를 목표로 하는 새로운 분자 메커니즘을 탐구하는 것이 필수적이다. 그것의 복제를 억제하는 주요 바이러스성 단백질과 직접적으로 상호작용하는 약물을 찾는 대신에, 대안적이고 아마도 추가될 수 있는 접근법은 바이러스가 숙주 세포를 감염시키고 한 세포에서 다른 세포로 퍼지도록 하는 숙주 세포 기계를 분해하는 것이다. 그러한 기계의 훌륭한 예는 수많은 코로나바이러스에서 바이러스 병원체에서의 역할이 증명된 숙주 세포 단백질이다. 이 검토에서 우리는 SARS→CoV→2 감염을 해결하기 위한 두 가지 치료 방식을 제안한다. 첫째는 세포 단백질과 그 내생성 억제제의 표현을 전사적으로 변조하는 것이고 둘째는 효소 활성을 직접적으로 억제하는 것이다. 우리는 이러한 메커니즘 중 하나에 의해 작용하여 전임상 체외 검사 및 COVID α19 환자들의 임상 시험을 위한 유망한 후보자를 대표하는 임상 조사 약물의 비배타적 컬렉션을 제시한다.
약어
ARDS
급성 호흡기 질환 증후군
COVID假19
코로나 바이러스 질병 19
사스 코브 2
코로나 바이러스 증후군假2
세계보건기구
1 INTRODUCTION
Coronavirus disease 19 (COVID19) pandemic is one of the major challenges that is currently facing human societies throughout the globe. At the time of writing this review, the number of confirmed cases according to the World Health Organization (WHO) is approaching 55 million and the death toll is exceeding 1.3 million worldwide.1 COVID19 is caused by severe acute respiratory syndrome coronavirus2 (SARSCoV2) infection in the respiratory tract. Many susceptible patients progress to a severe form of the disease that is characterized by an acute respiratory distress syndrome (ARDS),2 which severely compromises their respiratory function and often causes organ failure and death. Understanding the mechanism by which the virus infects its host cells in the respiratory tract and spreads through the lung tissue causing its damage is of extreme importance to find an effective treatment. The key viral protein that enables members of the coronavirus family including SARSCoV2 to infect their host cells is the spike (S) protein. It is the largest structural protein existing in the virus particles with an overall length ranging between 1200 and 1400 amino acids and is organized into homotrimers that are integrated into the viral envelope giving rise to its characteristic coronashaped structure.3 It possesses a large ectodomain, a small transmembrane domain, and a short endodomain. Like all class I viral fusion proteins, the S protein ectodomain is divided into two functional domains: S1 domain which binds to host cell receptors and S2 domain which mediates the fusion between the viral envelope and the host cell membrane. In order for the fusion machinery of the S2 domain to be active, the S protein has to undergo proteolytic processing by a variety of host cell protease enzymes that are able to cleave its ectodomain at a number of specific sites (Figure 1B). Two of these cleavage sites have been well characterized in SARSCoV1, namely the S1/S2 site at the boundary between these two domains and the S2’ site which exists within the S2 domain itself4 (Figure 1A). Likewise, a multibasic cleavage site at the S1/S2 boundary has been characterized in the SARSCoV2 S protein.5 It is worth to mention that these proteasecatalyzed cleavage events can take place on the cell surface before viral entry into its host cell, inside endosomes during viral entry and in the cytosol during viral protein synthesis by the infected cell. This is why host cell proteases are believed to play a pivotal role in the pathogenesis of many human coronaviruses as well as other pneumotropic viruses such as influenza.
1 소개
코로나 바이러스 질병 19(COVID假19) 전염병은 현재 전 세계적으로 인간 사회가 직면하고 있는 주요 과제 중 하나이다. 이 리뷰를 작성하는 시점에, 세계보건기구(WHO)에 따라 확인된 환자의 수는 5천 5백만 명에 육박하고 사망자 수는 전 세계적으로 130만 명을 넘는다.1 COVID²19는 호흡기의 심각한 급성 호흡기 증후군 코로나바이러스 假2 (SARS→CoV²2) 감염에 의해 발생한다. 많은 취약한 환자들은 급성 호흡기 질환 증후군(ARDS)으로 특징지어지는 심각한 형태의 질병으로 진행되며, 2는 호흡 기능을 심각하게 손상시키고 종종 장기 기능 상실과 사망을 유발한다. 바이러스가 호흡기에서 숙주 세포를 감염시키고 폐 조직을 통해 퍼지면서 손상을 일으키는 메커니즘을 이해하는 것은 효과적인 치료법을 찾는 데 매우 중요하다. SARS→CoV→2를 포함한 코로나 바이러스 계열의 구성원들이 숙주 세포를 감염시킬 수 있는 핵심 바이러스성 단백질은 스파이크 단백질이다. 이 단백질은 1200~1400 범위의 전체 길이를 가진 바이러스 입자에 존재하는 가장 큰 구조 단백질이며, 바이러스 봉투에 통합된 호모트리머로 구성되어 특유의 코로나 모양의 구조를 형성합니다.3 그것은 큰 외계 도메인, 작은 외계 도메인, 그리고 짧은 내계 도메인을 가지고 있다. 모든 등급 I 바이러스 핵융합 단백질과 마찬가지로, S 단백질 세포영역은 두 가지 기능 영역으로 나뉘는데, S1 도메인은 숙주 세포 수용체에 결합되어 있고 S2 도메인은 바이러스 봉투와 숙주 세포막 사이의 핵융합을 매개한다. S2 영역의 핵융합 기계가 활성화되기 위해서는 S단백질이 다수의 특정 부위에서 자신의 세포영역을 분할할 수 있는 다양한 숙주세포 단백질 분해효소에 의한 단백질 분해 과정을 거쳐야 한다(그림 1B). 이러한 분열 부위 중 두 개는 SARS→CoV→1에서 잘 특징지어진다. 즉, 이 두 도메인 사이의 경계에 있는 S1/S2 사이트와 S2 도메인 자체 내에 존재하는 S2' 사이트이다(그림 1A). 마찬가지로, S1/S2 경계에 있는 다원적 균열 부위는 SARS→CoV→2S 단백질로 특징지어졌다.5 이러한 프로테아제 촉매 분해된 갈라짐 현상은 바이러스가 숙주 세포로 들어가기 전 세포 표면, 바이러스 유입 중 엔도솜 내부, 감염된 세포에 의한 바이러스 단백질 합성 중 사이토솔에서 발생할 수 있다는 것을 언급할 가치가 있다. 이것이 숙주 세포 단백질이 인플루엔자와 같은 다른 공압성 바이러스뿐만 아니라 많은 인간 코로나 바이러스의 병리 발생에 중추적인 역할을 한다고 믿어지는 이유이다.
?
6 CONCLUSION AND OUTLOOK
In summary, we emphasize the importance of host cell proteases as potential drug targets for the treatment of SARSCoV2 infection and highlight therapeutic mechanisms that have not been sufficiently exploited to impair the virus capacity to spread through its host cells. We present a collection of clinically approved drugs as well as drugs under investigation that either suppress the transcription of proteases or increase the expression of their natural protease inhibitors. We also include drugs that are reported to possess protease inhibitory activity. These are believed to be potential candidates for drug repurposing and immediate preclinical testing in cell line models to verify their efficacy. As many of these candidates have been in clinical use for several years and their safety profiles are well established, we encourage their rapid clinical testing in patients with COVID19 in combination with antiviral drugs. This would constitute a twohit approach where not only viral proteins/enzymes necessary for viral replication are targeted but also the host cell machinery that the virus takes advantage of to facilitate its propagation in its infected host.
7 NOMENCLATURE OF TARGETS AND LIGANDS
Key protein targets and ligands in this article are hyperlinked to corresponding entries in http://www.guidetopharmacology.org, the common portal for data from the IUPHAR/BPS Guide to PHARMACOLOGY,118 and are permanently archived in the Concise Guide to PHARMACOLOGY 2019/20.119
DISCLOSURE
None.
AUTHOR CONTRIBUTIONS
IAS and MMAM conceptualized the idea in consultation with MAH. IAS and MMAM reviewed literature and wrote the initial draft. MAH and SSH critically reviewed the initial draft and expanded certain sections of the review. All authors contributed to revising the manuscript in view of reviewers’ comments. All authors have read and approved the final version for publication.
결론 및 전망
요약하면, 우리는 SARS→CoV→2 감염 치료를 위한 잠재적인 약물 대상으로서 숙주 세포 단백질의 중요성을 강조하고 숙주 세포를 통해 확산될 바이러스 용량을 충분히 손상시킬 만큼 충분히 이용되지 않은 치료 메커니즘을 강조한다. 우리는 단백질 분해효소의 전사를 억제하거나 자연 단백질 분해효소 억제제의 발현을 증가시키는 연구 중인 약뿐만 아니라 임상적으로 승인된 약물의 컬렉션을 제시한다. 우리는 또한 단백질 분해효소 억제 활동을 가지고 있다고 보고된 약물을 포함한다. 이들은 약물 용도 변경 및 세포 라인 모델에서 즉시 전임상 시험을 통해 효능을 검증할 수 있는 잠재적 후보자로 여겨진다. 이러한 후보자들 중 많은 수가 몇 년 동안 임상적으로 사용되었고 그들의 안전 프로필이 잘 확립되었으므로, 우리는 항바이러스 약물과 결합하여 COVID19 환자들에 대한 신속한 임상 시험을 권장한다. 이것은 바이러스 복제에 필요한 바이러스성 단백질/효소뿐만 아니라 바이러스가 감염된 숙주에 전파를 용이하게 하기 위해 이용하는 호스트 세포 기계까지 대상으로 하는 2개의 히트 방식을 구성한다
7 대상 및 리간드 지명
본 문서의 핵심 단백질 대상 및 리간드는 약리학에 대한 IUPHAR/BPS 가이드에서 약리학, 118까지의 공통 데이터 포털인http://www.guidetopharmacology.org의 해당 항목과 하이퍼링크되며 약리학 2019/20.119에 대한 간결한 가이드에 영구히 보관된다.
공개
없음
저자의 기여
IAS와 MMAM은 MAH와 협의하여 아이디어를 개념화하였다. IAS와 MMAM은 문헌을 검토하고 초안을 작성하였다. MAH와 SSH는 초기 초안을 비판적으로 검토하고 검토의 특정 섹션을 확장했습니다. 모든 저자들은 검토자들의 의견을 고려하여 원고를 수정하는 데 기여했다. 모든 저자들은 최종본을 읽고 출판에 대한 승인을 받았다?
게시글 찬성/반대
- 0추천
- 0반대
운영배심원의견
운영배심원의견이란
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.






댓글목록